
实验1:用pH试纸测试滤液 pH,其pH约为1;
实验2:取少量滤液于试管中,向试管中滴加氯化钡溶液,有白色沉淀现象。
你认为,可说明硫酸有剩余。(选填“实验1”或“实验2”)
Ⅰ.同学们作出猜想
猜想一:是小水滴.因为盐酸溶液中的水受热会汽化上升,在试管口 成小水滴(填物态变化名称)。
猜想二:是盐酸小液滴.因为浓盐酸具有 性,可能实验中使用的盐酸浓度过高,试管口就会形成盐酸小液滴。
同学们将干燥的蓝色石蕊试纸放在内有正在反应的镁条和盐酸的试管口,试纸变红,证明猜想二是合理的。
Ⅱ.小柯提出质疑
为什么刚才打开盛放实验所用盐酸的试剂瓶,瓶口没有白雾,却在反应过程中出现白雾?
小柯联系反应时试管外壁很烫,于是想到:白雾的形成可能与温度有关.
他用试管取少量盐酸,将干燥的蓝色石蕊试纸放在试管口,试纸不变红;然后 (填操作),试纸变红。
得出结论:这种盐酸浓度并不高,是镁和盐酸反应放热促使盐酸形成白雾。
①先用天平称取质量为m1的金属锡粉.
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为m2 .
③打开容器,听到了空气进入容器发出的“丝丝的声响”,称量所得白色物质的质量为m3 .
④把白色物质放回原容器里(容器中空气的组成恢复到初始状态),重新称量容器的总质量为m4
小金进行如图所示实验来验证质量守恒定律。在实验中用电子天平和量筒准确测量出表中m1、m2、m3、m4和V。(实验中操作正确,O2的密度为ρg/cm3)
| 实验序号 | 1 | 2 | … |
| m1(MnO2)/g | |||
| m2(KClO3)/g | |||
| m3(试管)/g | | ||
| m4(试管+加热后剩余固体)/g | | ||
| 量筒内收集气体的体积V/cm3 | |

第1步:2MnO2+2KClO3 2KMnO4+Cl2↑+O2↑
第2步:2KMnO4 K2MnO4+MnO2+ O2↑
第3步:K2MnO4+ Cl2 2KCl+ MnO2+ O2↑
写出加热后剩余固体中MnO2质量小于加热前MnO2质量的原因。
白醋(含3%的醋酸)、食品干燥剂(主要成分是CaO)、鸡蛋壳、牵牛花汁液、铁钉、苏打(碳酸钠)。
【查阅资料】牵牛花汁液在酸性溶液中显红色,在中性溶液中显紫色,在碱性溶液中显蓝色。
【实验过程】
步骤 | 操作 | 现象 |
1 | 将食品干燥剂加入适量清水中,搅拌后静置 | 放出大量的热 |
2 | 取步骤1中的上层清液,先加入牵牛花汁液, | 溶液由无色变为蓝色,再变为紫色,最后变为红色 |
【评价反思】科学来源于生活,生活中的许多事物能更好地帮助我们学习和理解科学。
【建立猜想】①两种酸溶液的pH不同.(注:pH相同,则单位体积溶液中H+数目相同)
②两种酸溶液中的不同.
【实验过程】
|
实验次数 |
试剂 |
实验条件 |
实验现象 |
|
1 |
0.2克CuO粉末+6毫升pH=0的盐酸 |
常温 |
黑色粉末很快溶解,溶液呈蓝绿色 |
|
2 |
0.2克CuO粉末+6毫升pH=0的硫酸 |
常温 |
无明显现象 |
|
3 |
0.2克CuO粉末+6毫升pH=0的硫酸+0.35克NaCl |
常温 |
黑色粉末很快溶解.溶液呈蓝绿色 |
|
4 |
0.2克CuO粉末+6毫升pH=0的硫酸+0.35 |
常温 |
无明显现象 |
【实验结论】常温下,pH相同的盐酸和硫酸溶液于CuO反应现象出现差异的原因是由于促进了反应的进行.
【查阅资料】①水溶液中的复分解反应一般朝着溶液中离子浓度(单位体积溶液中离子数目的多少)减少的方向进行.
②了解到某些难溶性盐的溶解能力和颜色.
【实验取证】取一支试管,加入少量AgNO3溶液,再加入过量NaCl溶液,有白色沉淀生成.
再往该试管中加入少量KI溶液,白色沉淀转化为黄色沉淀.
【分析讨论】( 1 )为什么要加入过量的NaCl溶液?请说明理由.
( 2 )写出加入少量KI溶液后发生反应的化学方程式.
( 3 )该反应能发生的原因是AgI在水中的溶解能力AgCl(选填“大于”、“等于”或“小于”).
【得出结论】某些可溶性盐和难溶性盐之间能发生复分解反应.
【提出问题】氢氧化钠是否完全变质?
【猜想与假设】
①部分变质,固体是NaOH和Na2CO3的混合物;
②全部变质,固体是Na2CO3 .
【查阅资料】
①Na2CO3溶液与FeCl3溶液会发生反应,有红褐色絮状沉淀等现象出现;
②NaCl溶液和BaCl2溶液均呈中性.
步骤 | 实验操作 | 实验现象 |
1 | 取少量固体于小烧杯中,加水充分溶解 | 固体全部溶解 |
2 | 取少量烧杯中的溶液于试管中,加入过量的BaCl2溶液 | 产生白色沉淀 |
3 | 取 △ 于另一试管中,再加入少量FeCl3溶液 | 产生红褐色絮状沉淀 |
【解释与结论】
①请将步骤3实验操作补充完整;
②步骤2加入过量BaCl2溶液的目的是;
③根据实验现象,可确定该固体是NaOH和Na2CO3的混合物.
得出结论:.
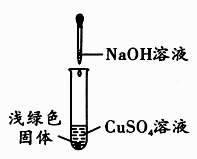
【查阅资料】
①NaOH与CuSO4反应会生成Cu(OH)2 , 也会生成Cu4(OH)6SO4(碱式硫酸铜)。
②Cu(OH)2在80℃会分解生成CuO
③Cu4(OH)6SO4不溶于水,能与酸反应,分解温度需300℃
【猜想与假设】
NaOH溶液
猜想一:浅绿色固体为Cu(OH)2;
猜想二:浅绿色固体为Cu4(OH)6SO4;
猜想三:浅绿色固体为Cu(OH)2和Cu4(OH)6SO4
【获取事实与证据】
小明同学联想到在做“固体碘溶解在酒精中”的实验时,酒精作为溶剂能溶解固体碘。酒精能否溶解氢氧化钠和碳酸钠呢?小明查阅资料并通过实验获知:氢氧化钠不与酒精发生化学反应,但能溶解在酒精中形成无色透明的溶液,氢氧化钠的酒精溶液与氢氧化钠的水溶液化学性质相似,碳酸钠不与酒精反应也不溶于酒精。
至此,小明同学对自己提出的问题有了清晰的解决方案。
小明同学的解决方案是。
写出解决方案中涉及到的化学方程式:。
①挑选均匀一致、色泽明亮的饱满莴苣叶种子,用体积分数20%的乙醇溶液消毒,蒸馏水洗净,然后用滤纸吸干水分。
②在铺有一层脱脂棉的培养皿中预先分别加入不同浓度的硫酸铜溶液,每瓶均匀放置50粒种子,于25℃恒温箱内培养。每天喷适量蒸馏水,保证种子的正常发育。
③每天观察记录种子发育情况,第14天时测定萌发幼苗的根长、芽长,所得实验数据如下表所示。
CuSO4溶液浓度(毫克/升) | 根长(厘米) | 芽长(厘米) |
0 | 1.02 | 2.43 |
50 | 0.81 | 2.22 |
100 | 0.52 | 2.13 |
150 | 0.49 | 1.96 |
200 | 0.32 | 1.54 |
【查阅资料】钠常温下就能与水发生剧烈反应,反应方程式为:2Na+2H2O==2NaOH +H2↑。
【提出猜想】猜想一:金属钠和硫酸铜溶液反应会有铜生成。
猜想二:金属钠和硫酸铜溶液反应,生成的沉淀只有氢氧化铜。
【实验及现象】切取不同大小的钠块分别投入到两种不同浓度的硫酸铜溶液中,有关产生沉淀
的现象如下表所示。
实验编号 | 钠块大小 | 硫酸铜溶液 | 实验中产生沉淀的现象 |
① | 绿豆大小 | 稀溶液10mL | 产生蓝绿色沉淀 |
② | 绿豆大小 | 浓溶液10mL | 产生蓝色絮状沉淀 |
③ | 豌豆大小 | 稀溶液10mL | 产生蓝色絮状沉淀 |
④ | 豌豆大小 | 浓溶液10mL | 产生蓝色絮状沉淀,并出现黑色固体 |
小科咨询老师后得知蓝绿色沉淀为碱式铜盐。
b.实验①中观察到的沉淀是蓝绿色的,由此判断猜想二也错误。
实验中生成氢氧化铜沉淀的原理是。 由上述实验可知,导致钠和硫酸铜溶液反应的产物不同的因素有
方案一:把钠块和无水硫酸铜直接混合,在干燥的空气中加热。
方案二:把钠块和无水旒酸铜直接混合,隔绝空气加热。
请从两个方案中选出合理的方案,并说明理由。
小明在学习金属活动性顺序后,知道钾、钙、钠金属活动性特别强,能与水反应生成碱和氢气,他想镁紧排在钠后面,它是否也能与水反应呢?
【提出问题】镁是否能与水反应?
【实验探究】在两个烧杯中,分别加入等量的冷水和镁条,用酚酞作指示剂,实验过程和现象如图:
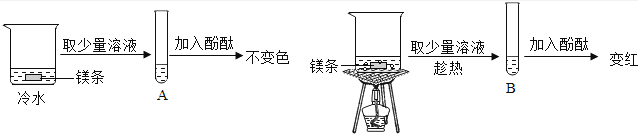
【反思与总结】
猜想 | 验证方案 |
可能是氢氧化镁的溶解度受温度的影响,温度降低,溶解度变小,从而导致溶液碱性减弱 | 将褪色后的溶液 , 如果溶液变红,说明小明的猜想正确 |
小明通过实验证明了自己的猜想是正确的。
【提出问题】白色固体的成分是什么?
【建立假设】假设一:白色固体的成分是氧化钠;
假设二:白色固体的成分是碳酸钠;
假设三:白色固体的成分是氯化钠和碳酸钠的混合物。
【进行实验】
步骤1:取燃烧匙上灰白色固体于烧杯中,加入适量的水充分溶解,过滤,得到滤液;
步骤2:取少量步骤1中的滤液与试管中,滴加2滴酚酞试液,溶液变成红色。结论:白色固体的成分是氧化钠。
【实验目的】确定白色固体的组成
【实验方案】
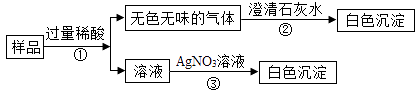
【实验结论】该白色固体由NaHCO3和NaCl两种物质组成,
则步骤②中发生的化学方程式是。
【实验目的】测定该白色固体中NaHCO3的质量分数
为了测定该样品中NaHCO3的质量分数,小吕、小周分别取a克该样品,设计了如下方案:
小吕方案Ⅰ:利用NaHCO3与稀硫酸反应产生CO2 , 通过测定生成CO2的质量,计算样品中NaHCO3的质量分数。
小吕用下列装置完成本实验,装置的连接顺序是 (填装置的字母编号,装置不重复使用);(C中碱石灰的作用:吸收空气中倒吸入的的水和二氧化碳)
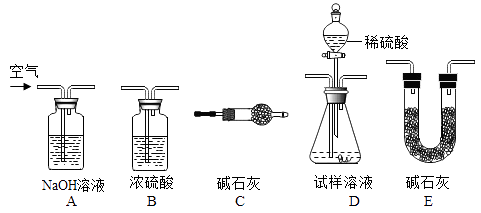
D装置中的反应完全后,需再次通入空气,其目的是__。
小周方案Ⅱ:小周用沉淀法测定样品中NaHCO3的质量分数。操作流程如下:
(已知:NaHCO3+NaOH=Na2CO3+H2O)

为使定量分析更准确,在操作Ⅰ之前,需判断所加BaCl2溶液是否过量,请你设计一个合理方案:。
科学兴趣小组的同学在学了俗称为苏打的碳酸钠后,得知它还有一个俗称为小苏打的“兄弟”,这个“兄弟”的性质是否和它相似?它们之间能发生转化吗?
小明查阅了资料,将相关信息整理如表:
俗名 | 苏打 纯碱 | 小苏打 |
化学式 | Na2CO3 | NaHCO3 |
构成微粒 | Na+ CO32﹣ | Na+ HCO3﹣ |
溶解度(常温) | 21.5克 | 9.6克 |
两者的转化 | Na2CO3+CO2+H2O═2NaHCO3 | 2NaHCO3 |
下面是小明同学进行的探究:
某小组在科学社团课上了解到氨水是由氨气溶于水并与水发生反应形成的.氨水中除NH3、H2O外,还有氨气和水发生反应的生成物,其中的生成物使氨水呈碱性。小组同学想用所学的知识对“氨气和水反应的生成物使氨水呈碱性”进行验证。
【查阅资料】
①氨气有毒,不易燃烧,极易溶于水;
②氨气可通过易挥发的浓氨水滴加到氧化钙中快速得到;
③红色石蕊试纸遇碱性溶液会变蓝色。
【实验方案】
小组设计如图所示装置,分别检测H2O、NH3和氨水使干燥红色石蕊试纸的变色情况。
【实验步骤】
①连接实验装置,检查气密性后添加药品;
②挤压C装置中的胶头滴管,C中试纸不变色,证明了 ;
③打开分液漏斗活塞,将浓氨水滴加到氧化钙上,一段时间后观察到B、C装置中的石蕊试纸均变蓝。
小组成员分析B装置中试纸变蓝的原因可能是由于 对实验造成干扰。
他们改进装置并重新实验,观察到B中试纸不变色,C中变蓝。
【实验结论】氨气和水反应的生成物使氨水呈碱性。
【反思评价】小组同学反思实验过程,认为本实验还需要对氨气进行尾气处理.你的处理方法是 。