| 金属 | Cr | Al | Cu |
| 与盐酸反应发生现象 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
【控制实验条件】(2)打磨三种金属发生的是变化;上述实验使用等浓度的盐酸溶液的理由是 .
【得出结论】(3)原假设中正确的是(填假设中a,b或c).写出铬(铬与盐酸反应后显+2价)与盐酸反应的化学方程式 .
【结论应用】(4)根据探究结果,在CuCl2和AlCl3的混合液中加入一定量的金属铬,充分反应后过滤,向滤出的固体中加入盐酸,无明显现象,则滤液中一定含有的溶质是 .
| 金属 | Ti | Al | Cu |
| 与盐酸反应现象 | 反应缓慢 | 反应剧烈 | 无明显现象 |
实验现象,实验结论:
(1)原假设中不正确(填“a”、“b”或“a、b”).
(2)三种金属的金属活动性由强至弱的顺序为。
结论应用:能否用铝制容器来盛装波尔多液(含硫酸铜),(填“能”或“否”),理由是。
【提出问题】二氧化硫与二氧化碳是否具有相似的化学性质呢?
【查阅资料】二氧化硫具有漂白性,其原因是二氧化硫与某些有色物质(如品红溶液)反应生成不稳定的无色物质,实验室常用红色的品红溶液检验二氧化硫的存在.
【实验探究】实验装置如图所示.
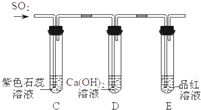
①装置C中紫色石蕊溶液变红,是由于二氧化硫与水反应生成了亚硫酸(H2SO3);装置D中澄清石灰水变浑浊.
②装置E的试管中溶液变无色,取该溶液加热,溶液又变为红色,其原因是.
③此装置有一个明显的不足之处是.
【得出结论】二氧化硫与二氧化碳有相似的化学性质,但二氧化硫还具有某些特殊的化学性质.
【反思提高】活性炭也能使品红溶液褪色,其褪色原理与二氧化硫使品红溶液褪色的原理是否相同,为什么.
从科学探究的角度看,你认为姜华的判断是否严密?.你的理由是.
请针对你的理由设计实验方案进行验证.(指示剂限用蓝色石蕊试纸)
实验操作 | 实验现象及结论 |
硫磺熏制的一次性筷子用水浸泡可降低SO2的含量,这说明SO2具有的物理性质是 , 为了研究SO2的性质,某同学做了如右图所示的实验:集气瓶中收集的是SO2 , 瓶内导管上系着瘪气球,通过胶头滴管向瓶中滴加紫色石蕊试液振荡,发现试液变红、气球膨胀,说明SO2可以跟 反应,化学方程式为 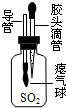

①金属X的试管中,最终还能观察到溶液变为浅绿色,证明X为.
②金属Y可能是(填字母序号).
A.Mg B.Ag C.Hg D.Zn
③四种金属中,在金属活动性顺序表中位于氢后的是,为进一步确定位于氢后金属的活动性相对强弱,还应补充的实验方案为(试剂可自选).
小李学习了二氧化碳知识后,进行了二氧化碳气体在水中溶解性的探究,其实验步骤及装置如下.

①用大号针筒抽取200毫升二氧化碳气体.
②试剂瓶中加入200毫升水,塞紧双孔橡皮塞.
③连接大号针筒和试剂瓶,缓慢推动活塞,将二氧化碳注入水中.
硫酸是常见的酸,也是常用的化工原料,由于浓度不同,浓硫酸与稀硫酸在在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等,某课外兴趣小组为了探究浓硫酸的某些特性做了如下﹣些实验,请结合有关实验,按要求回答下列问题:

①稀释浓硫酸时,应将缓缓地注入盛有的烧杯中并不断搅拌
②由如图曲线你能得到的实验结论有(填序号)
A.只有浓硫酸具有吸水性
B.浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大)
C.开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越强
D.硫酸浓度越稀,吸水性越弱,到﹣定浓度就失去吸水性.