①Na2O2﹣供氧剂
②晶体Si﹣太阳能电池
③AgI﹣人工降雨
④NaCl﹣制纯碱
⑤Al2O3﹣焊接钢轨
⑥NaClO﹣消毒剂
⑦Fe2O3﹣红色油漆或涂料
⑧SO2﹣食品防腐剂
⑨NH3﹣制冷剂
⑩水玻璃﹣耐火材料.
![]()
 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B .
向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B .  向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C .
向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C .  向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D .
向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D .  向NaAlO2溶液中逐滴加入盐酸至过量
向NaAlO2溶液中逐滴加入盐酸至过量
甲组 | ①Al(OH)3 ②SiO2 ③FeCl3溶液 ④SO2 |
乙组 | a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液 |
编号 | ① | ② | ③ | ④ |
气体M | H2S | NH3 | HI | NO |
气体N | SO2 | HCl | Cl2 | O2 |
![]()

序列 | 参加反应的物质 | 生成物 |
① | MnO4﹣ … | Cl2、Mn2+ … |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 … |

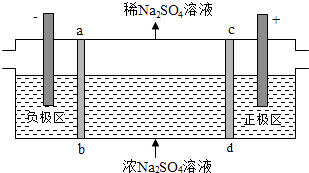

请回答下列问题:
a.一定有 b.一定没有 c.可能有.
①保存FeCl2溶液时,需向溶液中加入少量Fe
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉﹣碘化钾溶液中滴加几滴FeCl2的浓溶液,原无色溶液变为蓝色
⑤纯铁与稀盐酸反应产生氢气的速率较慢;再加入少量CuCl2•2H2O晶体,速率加快
a.NaOH溶液 b.氨水 c.CO2 d.盐酸
LiAlH4+=++.

已知:①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
(i)装置A三颈烧瓶中发生反应的化学方程式为.
(ii)B装置的目的是.
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置发生反应的离子方程式是.
准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解.用a mol•L﹣1酸性KMnO4溶液滴定,达滴定终点时所用KMnO4溶液体积为bmL.则样品中NaNO2的质量分数为.
(假设样品中其他杂质与酸性KMnO4溶液不反应,用含m、a、b的代数式表示.)

已知某些氢氧化物沉淀的pH如下表所示:
|
氢氧化物 |
开始沉淀时的pH |
完全沉淀时的pH |
|
Mg(OH)2 |
9.3 |
10.8 |
|
Fe(OH)2 |
7.6 |
9.6 |
|
Fe(OH)3 Al(OH)3 |
2.7 3.7 |
3.7 4.7 |