N2(g)+
H2(g)=NH3(g)△H=﹣46.19kJ•mol﹣1
H2(g)+
Cl2(g)=HCl(g)△H=﹣92.36kJ•mol﹣1
I2(g)+
H2(g)=HI(g)△H=﹣4.74kJ•mol﹣1 .

②C2H5OH(g)=C2H5OH(l)△H2=﹣b kJ•mol﹣1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=﹣c kJ•mol﹣1
根据盖斯定律判断:若使46g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为( )
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=﹣452kJ•mol﹣1
根据以上热化学方程式判断,下列说法正确的是( )
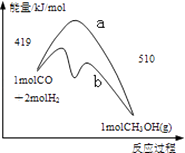
 图可表示由CO生成CO2的反应过程和能量关系
B . CO的燃烧热为566 kJ/mol
C . Na2O2(s)+CO2(s)=Na2CO3(s)+
图可表示由CO生成CO2的反应过程和能量关系
B . CO的燃烧热为566 kJ/mol
C . Na2O2(s)+CO2(s)=Na2CO3(s)+ 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
 B .
B .  C .
C .  D .
D . 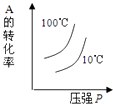

A | B | C | D | |
研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
图示 |
|
|
|
|

下列说法正确的是( )
容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |

CrO42﹣ Cr2O72﹣
Cr3+
Cr(OH)3↓
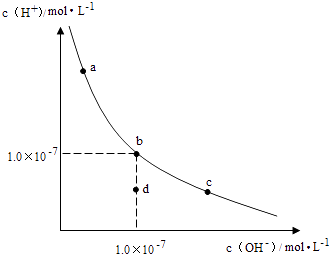
已知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )

 图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJ•mol﹣1
B .
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJ•mol﹣1
B .  图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C .
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C .  图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D .
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
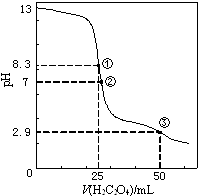
D .  图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强


a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
元素 | 相关信息 |
X | X的一种核素的原子核中没有中子 |
Y | Y原子的核外电子占据4个原子轨道 |
Z | Z的气态氢化物能使湿润的红色石蕊试纸变蓝 |
R | R是地壳中含量最高的元素 |
M | M的单质与冷水剧烈反应,生成的强碱中含有电子数相同的阴阳离子 |