小明在家中自制紫甘蓝汁,并测试其在酸性、中性、碱性条件下颜色(如图).他找到饮水机清洁剂(含盐酸)、食盐水、纯碱水、小苏打水和石灰水,开始了他的家庭实践活动.
资料:
物质 | 碳酸钠 | 碳酸氢钠 |
20℃溶解度/g | 21.5 | 9.6 |
水溶液的pH | 11 | 9 |
(1)纯碱的化学式为 .
(2)将紫甘蓝汁滴入溶液A中,紫甘蓝汁显红色,则A溶液是 .
(3)将B溶液滴入A中,无明显现象,由此得出的结论是 .
(4)将C溶液滴入D、E中,均有沉淀产生,该过程的反应之一是(用化学方程式表示) .
(5)为进一步区别D、E,小明试着向其溶液中分别通入CO2 , 观察到D中有沉淀产生,E中无明显现象,试推测D的成分并说明理由 .

【实验探究】
请你依据图设计一个酸和碱反应的探究实验:

实验步骤 | 实验现象 | 结论 |
①向烧杯中加入10mL氢氧化钠溶液,并滴入几滴酚酞试液 | ①溶液颜色; | 酸和碱发生了中和反应 |
②再用滴管慢慢滴入稀硫酸,并不断搅拌溶液. | ②不断搅拌溶液至溶液颜色变成色. |
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
甲同学的方案 | 取样,滴入适量的氯化钡溶液 | 出现白色沉淀 | 硫酸过量 |
乙同学的方案 | 取样,滴入几滴无色酚酞溶液 | 酚酞溶液不变色 | 酸、碱恰好完全反应 |
丙同学的方案 | 取样,滴入几滴紫色石蕊溶液 | 溶液变红 | 硫酸过量 |
【实验评价】
①设计的三个方案中,有一个正确的方案,是(填“甲”、“乙”、“丙”)同学的方案.
②请分析另外两个同学方案错误的原因:一个同学方案错误的原因是 .
【实验反思】探究硫酸和氢氧化钠反应后硫酸是否有剩余,还可选择一种试剂 .
将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图.某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:

猜想Ⅰ:pH增大是因为;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式 .
为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
(1)向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7.
(2)向2mL0.4%的盐酸中加入VmL , 用pH计测得混合液的pH7(填“>”、“=”或“<”).
综合(1)和(2)证明猜想Ⅱ成立.
某校同学开展了如图所示“溶液酸碱性的检验”的实验活动:

溶液 | 白醋 | 盐酸 | 蔗糖水 | 草木灰水 | 石灰水 |
加入紫薯汁后的颜色 | 红色 | 红色 | 紫色 | 绿色 | 绿色 |
①图1中存放紫薯汁的仪器名称是;
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是.
探究学习小组在制作“叶脉书签”时,需要将树叶放在质量分数为10%的氢氧化钠溶液中煮沸,如图1所示为该小组配制10%的氢氧化钠溶液的操作过程:
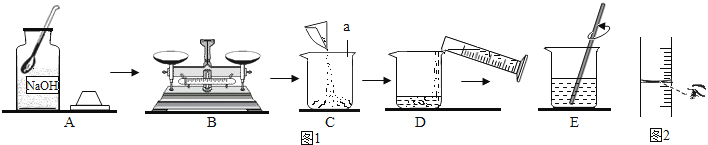
a.玻璃棒 b.pH试纸 c.酚酞试液 d.白瓷板(或玻璃片)
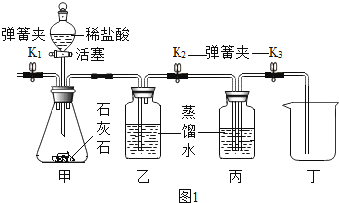
某小组在学习“二氧化碳制取的研究”课题时,探究了二氧化碳气体的收集方法.
【查阅资料】
通常状况下,1体积水约能溶解1 体积二氧化碳,所得溶液pH约为5.6.
【提出问题】
二氧化碳能不能用排水法收集?
【实验设计与操作】
实验一、在通常状况下,测定二氧化碳溶液水所得溶液调查pH,判断二氧化碳在水中溶解度的体积.

|
物质 |
丁装置中溶液 |
丙装置中溶液 |
|
pH |
6.50 |
5.60 |
分析可知,在丙和丁装置中所溶解二氧化碳的体积(填“大于”“小于”“等于”) 丙和丁装置中溶液的总体积.
实验二:在通常状况下分别测定排空气法和排水法收集的气体中氧气的体积分数,从而得到二氧化碳的体积分数.
化碳在水中溶解度的措施是 (写一条即可).