①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用
②纯铁比生铁抗腐蚀性更强
③单质铝在空气中比较耐腐蚀,所以铝是不活泼金属
④向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生
⑤青铜、不锈钢、硬铝都是合金
⑥可通过焰色反应区分钾元素和钠元素
⑦将FeCl3溶液滴入KI-淀粉溶液中,溶液变蓝色
⑧铝粉和氧化镁粉末混合,高温能发生铝热反应


| A | B | C | D | |
| a | NaHCO3 | Al | Fe | Cu(OH)2 |
| b | NaOH | Al2O3 | FeCl3 | CuSO4 |
| c | Na2CO3 | NaAlO2 | FeCl2 | CuCl2 |
a.若向其中一支试管中滴加KSCN溶液,则溶液变成色。
b.向另一支试管中滴加NaOH溶液,现象为,反应的离子方程式是。
将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+ , 可另取稀释液少许,滴加(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由。
最后逸出的气体具有可燃性,推测该气体为H2 , 理由是(用离子方程式表示)。

请回答该实验中的问题。
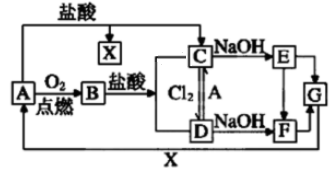
①C→E。
②A→C。

已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:


仪器X的名称是,其主要作用有导气、。
铜的测定:取20.00mL测液,经测定, 浓为
。则称取的样品中
mol。

①滴定时,应选用下列哪种物质作为指示剂(填标号)。
A. B.
C.
②重复实验操作三次,消耗 溶液的体积平均为10.00mL。则称取的样品中
mol。