 B .
B .  C .
C . 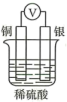 D .
D . 

②中和反应生成1mol水时的反应热(ΔH)为-57.3kJ·mol-1;
③水的汽化热(ΔH)为+44.0kJ·mol-1
下列热化学方程式书写正确的是( )
化学键 | H-C | C=C | H-O | C-O | C-C |
键能/( | 413 | 615 | 463 | 351 | 348 |
根据键能估算( )

a.盐酸的浓度b.NaOH溶液的浓度c.比热容d.反应后溶液的质量
e.生成水的物质的量f.反应前后溶液温度的变化g.操作所需的时间

请回答以下问题:
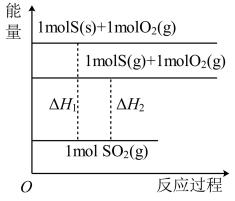
已知:。回答下列问题:
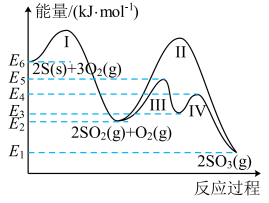
①SO2经过程III、过程IV转化成SO3;②SO2经过程II转化成SO3。已知过程IV的化学方程式为 , 则过程III的热化学方程式为。
②利用装置A进行实验,发现锌片、锰片质量均减轻,说明装置中除了发生电化学反应,还发生非电化学反应,该反应的离子方程式为。实验结束时测得电解质溶液增加32.8g,电流表中有1mol电子发生转移,则锌溶解了g。
②若装置B中负极金属的消耗速率为 , 则盐桥中K+的迁移速率为
。

已知:
快速制氢反应:的
。
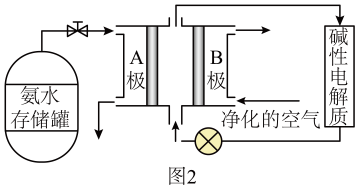
①极为氨气燃料电池的极。
②“净化的空气”是指在进入电池装置前除去(填化学式)的气体。
③氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上的电极反应式是。
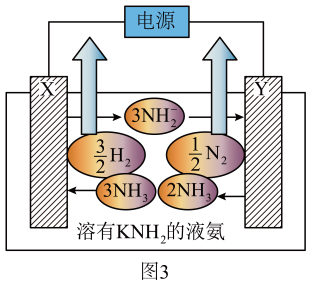
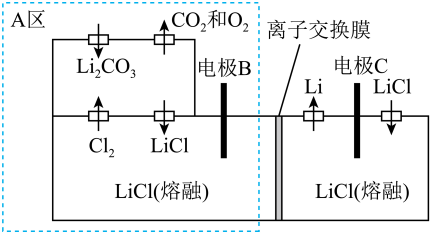
①电极的名称是。
②图3中阳极的电极反应式为。
③若图3中电解质改用 , 则阴极的电极反应式为。