
反应I:ClCH2CH2Cl(g)→HCl(g)+CH2=CHCl(g) ΔH1=+69.7 kJ•mol-1
反应Ⅱ:HC≡CH(g)+HCl(g)→CH2=CHCl(g) ΔH2=-98.8 kJ•mol-1
1.0×105Pa下,分别用如表三种方式进行投料,不同温度下反应达到平衡时相关数据如图所示。|
方式 |
气体投料 |
平衡时相关数据 |
|
甲 |
ClCH2CH2Cl |
ClCH2CH2Cl转化率 |
|
乙 |
n(HC≡CH):n(HCl)=1:1 |
HC≡CH转化率 |
|
丙 |
n(ClCH2CH2Cl):n(HC≡CH)=1:1 |
CH2=CHCl产率 |

下列说法错误的是
反应I:CO2(g)+H2(g) =CO(g)+H2O(g) ΔH=+41.2 kJ·mol−1
反应II:2CO2(g)+6H2(g) =CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol−1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。 (CH3OCH3的选择性=×100%)

下列说法错误的是( )
反应I.CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H1= - 49.4 kJ·mol-1
反应Ⅱ.CO2(g)+H2(g)=CO(g)+ H2O(g) △H2=+41.2 kJ ·mol-1
压强分别为p1、p2时,将 =1:3的混合气体置于密闭容器中反应,不同温度下体系中CO2的平衡转化率和CH3OH、CO的选择性如图所示。CH3OH(或CO)的选择性=

下列说法正确的是( )
已知:①该反应分两步完成,第一步为
②两步反应的活化能分别为Ea1、Ea2 , 且Ea1>Ea2
下列判断正确的是( )
反应Ⅰ:
反应II:
下列说法正确的是( )



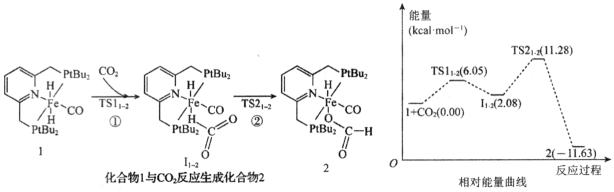



曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是。
①反应器中初始反应的生成物为 和
,其物质的量之比为4:1,甲烷和水蒸气反应的方程式是。
②已知反应器中还存在如下反应:
i.
ii.
iii.
·
Ⅲ为积碳反应,利用 和
计算
时,还需要利用 反应的
③反应物投料比采用 ,大于初始反应的化学计量数之比,目的是(选填字母序号)
a.促进 转化
b.促进 转化为
c.减少积碳生成
④用 可以去除
。
体积分数和
消耗率随时间变化关系如下图所示。

从 时开始,
体积分数显著降低,单位时间
消耗率(填“升高”“降低”或“不变”)。此时
消耗率约为
,但已失效,结合化学方程式解释原因:。

①制 时,连接。
产生 的电极方程式是。
②改变开关连接方式,可得 。
③结合①和②中电极3的电极反应式,说明电极3的作用:。
i.![]()
![]() (g) ΔH1=-271.96kJ·mol-1
(g) ΔH1=-271.96kJ·mol-1
ⅱ.![]()
 (g) ΔH2=-267.80kJ·mol-1
(g) ΔH2=-267.80kJ·mol-1
回答下列问题:

①表示HCl转化率的曲线为(填“L1”或“L2”),理由为。
②T1温度下丙烯转化率最高的原因为。
③已知T2温度下,平衡时2-氯丙烷的体积分数为10%,则1-氯丙烷的体积分数为(保留两位有效数字,下同);反应i的平衡常数 [对于反应
,
, x为物质的量分数]。
I.CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.3kJ·mol-1
Ⅱ.2CO(g)+4H2(g) C2H4(g)+2H2O(g) ΔH=+210.5kJ·mol-1
CO2加氢合成乙烯的热化学方程式为。
I.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—48.5kJ·mol-1
Ⅱ.2CO2(g)+5H2(g) C2H2(g)+4H2O(g) ΔH=+37.1kJ·mol-1
在压强为P,CO2、H2的起始投料为1:3的条件下,发生反应I、Ⅱ,实验测得CO2的平衡转化率和平衡时CH3OH的选择性随温度的变化如图所示:

已知:CH3OH的选择性=
①有利于提高CH3OH的选择性的措施有(填序号)。
A.适当降温 B.适当升温 C.选择合适的催化剂
②温度高于350℃时,体系中发生的反应以(填“I”或“Ⅱ”)为主,并说明理由。
③其中表示平衡时CH3OH的选择性的曲线是填“a”或“b”)。
④400℃时,在该压强及投料比的条件下,利用图示所给数据计算H2的转化率为(保留三位有效数字)。


a.升高温度 b.将平衡体系中的氨气分离出来
c.增大体系压强 d.加入合适的催化剂

①表示逆反应的平衡常数与温度变化关系的曲线为(填“L1”或“L2”),理由为。
②T0℃时,=。
主反应:C3H6(g)+NH3(g)+ O2(g)
C3H3N(g)+3H2O(g) ΔH= -515 kJ·mol-1;
副反应:C3H6(g)+O2(g) C3H4O(g)+H2O(g) ΔH=- 353kJ·mol-1。
已知:丙烯腈的产率=- ×100%,丙烯腈的选择性=
×100%,某气体分压=总压强 ×该气体物质的量分数。
①一定条件下,平衡时丙烯腈的选择性与温度、压强的关系如图3所示,则p1、p2、p3由大到小的顺序为。原因是。

②某温度下,向压强恒为100 kPa的密闭容器中通入1molC3H6、1molNH3和1.5molO2 , 发生上述反应。平衡时测得C3H6转化率为90%,H2O(g)的物质的量为2.5 mol,则平衡时C3H3N的分压为kPa(保留3位有效数字),此温度下副反应的Kp=。
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①“反应Ⅰ”能自发进行的条件是(填“高温”“低温”或“任意温度”)。
②某反应X的平衡常数表达式为 , 则反应X的热化学方程式为。
反应Ⅳ:
反应Ⅴ:
①该反应过程常用的催化剂有两种,ZSM-5以及SAPO-34,它们都是多孔笼状结构,ZSM-5笼状孔径约为0.55nm,SAPO-34约为0.4nm。相同条件下,催化剂SAPO-34反应(如图1)获得的产物中,n(C2H4):n(C3H6)更大的原因是。

②一定温度下,在体积为1L的密闭容器中投入2mol CH3OCH3发生“反应Ⅳ”和“反应Ⅴ”,初始总压为po , 反应到达平衡时总压为1.2po , 且n(C2H4):n(C3H6)=1:1。则平衡时体系CH3OCH3转化率α(CH3OCH3)=。“反应Ⅴ”的平衡常数Kp=。


①由图1可推知:该反应的0(填“>”或“<”);
②若系统碳中和反应为基元反应,且反应的与活化能(Ea)的关系为
。在图2中补充完成该反应过程的能量变化示意图。

③某小组模拟该反应,t℃下,向容积为10 L的密闭容器中通入5.2 mol 和0.9 mol
, 反应平衡后测得容器中
。则
的转化率为,平衡常数的值为。
催化剂 | ||||
A | 10.8 | 12722 | 345.2 | 41780 |
B | 9.2 | 10775 | 34 | 39932 |
①在选择使用催化剂A和350℃条件下反应,0~2 min生成的平均反应速率为
;
②若某空间站的生命保障系统实际选择使用催化剂B和400℃的反应条件,其理由是。
①
②
上述反应中C(ads)为吸附活性炭,反应历程的能量变化如图所示:

-
干重整反应的热化学方程式为(选用
、
、
、
、
的关系式表示反应热),反应Ⅱ是(填“慢反应”或“快反应”)。
③
④
如图所示,压强为kPa,温度低于700℃时,加入CaO可明显提高平衡体系混合气中
的物质的量,原因是。



2H2(g) + CO(g)= CH3OH(1) ΔH1= -116kJ ·mol-1
已知:CO(g) +O2(g) =CO2(g) ΔH2= -283 kJ ·mol-1
H2(g) +O2(g) =H2O(g) ΔH3= -242 kJ ·mol-1
H2O(g) =H2O(1) ΔH4= -44 kJ ·mol-1
表示甲醇燃烧热的热化学方程式为。

据模拟实验可知,该反应是(填“放热”或“吸热”)反应。平衡温度为750℃ ,水碳比为5时, H2的物质的量分数为0.3,则CH4的转化率为,用各物质的平衡分压计算Kp= MPa2。 (分压=总压 ×物质的量分数,结果保留2位小数)
3CH3OH(g)C3H6(g) + 3H2O(g)。

该反应VanˊtHoff方程的实验数据如图中曲线a所示,已知VanˊtHoff方程为+C(ΔH为该反应的焓变,假设受温度影响忽略不计,K为平衡常数,R和C为常数) ,则该反应的焓变ΔH =kJ·mol-1。对于另一反应实验数据如图中的曲线b所示,若该反应焓变为ΔH ',则△HΔH ' (填“>”“<”或“=”);此公式说明对于某个反应,当升高相同温度时,其ΔH 的数值越大,平常数的变化值就( 填“越多”或“越少”)。

过程ii的离子方程式是。

写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式:。



①(填“曲线a”或“曲线b”)表示的是下的
与p关系图像。
②当时,反应条件可能是。
a. b.
c. d.
e. f.
g.
①反应f为。实际生产中,原料气中和
物质的量之比为
。如此操作的原因有两点:、。
②已知:当2个原子被1个活性位吸附,这2个原子就容易成键。反应a~d中被1个活性位吸附的微粒是(填标号)。
A. B.H C.
D.N E.
③研究表明,某些物质(例如硫)能使催化剂永久中毒。依据上述反应机理分析催化剂中毒原因:。

反应物分子有效碰撞几率最大的步骤对应的基元反应为。
①
②
反应的ΔH=
。
[]

和
在某催化剂表面上合成
的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。

该反应历程中活化能最小步骤的化学方程式为。
化学键 | |||||
436 | 414 | 464 | 326 | 803 |
结合表中数据及反应历程图,写出由和
合成
的热化学方程式。

①、
、
从高到低排序为。
②请计算在温度下,该反应的压强平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留三位有效数字)。

上述脱除工艺中可循环利用的物质是;某温度下,当吸收塔中溶液
时,溶液中
(已知:该温度下
的
,
)。
在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~400℃时,生成乙酸的速率先减小后增大,理由是。

已知:C(s)+O2(g)⇌CO(g) △H1=-110.5kJ/mol ①
C(s)+CO2(g)⇌2CO(g) △H2=+552.5kJ/mol ②
工业上将一定比例的氧气和二氧化碳投入焦炭炉中反应,不同温度下,达到平衡时氧气和二氧化碳体积分数如图:

试解释随温度的升高氧气与二氧化碳的变化趋势的原因:;在850℃时反应炉中达到热平衡,则通入的n(O2):n(CO2)=(填,最简单整数比);此时反应器中压强为p0 , 则反应②的Kp=。

则曲线c表示的物质是;e点CO的转化率为;(用分数表达或保留三位有效数字)在M点平衡状态下进行压缩,则重新达到平衡,M点可能移到:。(填“不变”“O”“N”或“P”)。

①已知相关反应的能量变化如图所示,过程Ⅰ的热化学方程式为。

②关于上述过程Ⅱ的说法错误的是(填序号)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d. Fe3O4、CaO为催化剂,降低了反应的△H
③其他条件不变,在不同催化剂Ⅰ、Ⅱ、Ⅲ作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是。


图中采取的措施可提高原料转化率的是(填序号)。

序号 | 起始投入量 | 平衡转化率 | ||
NH3 | ||||
①恒温恒容 | 0 | |||
②绝热恒容 | 0 | |||
③恒温恒压 | 0 | |||
则:、
(填“>”、“=”或“<”)

①
;
②
;
③
。
试回答:
甲同学据此认为:“煤炭燃烧时加少量水,可以使煤炭燃烧放出更多的热量”。
乙同学根据盖斯定律作出了下列循环图

则合成氨反应的热化学方程式为。

前20min内 , 放出的热量为,25min时采取的措施是。
①该反应的平衡常数是。
②若2min时保持T℃和平衡时容器的压强不变,再向体积可变的容器中充入0.6mol , 则此时平衡(填“正向移动”“逆向移动”或“不移动”)