| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/克 | 硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
| 氯化钠 | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | |
温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 0.185 | 0.176 | 0.165 | 0.153 | 0.141 | 0.138 | 0.116 | 0.106 |


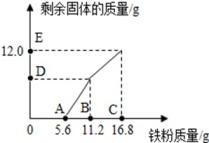

温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 |
KNO3溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | |
| 溶解度/g | 甲 | 0.18 | 0.16 | 0.14 | 0.12 | 0.09 |
| 乙 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | |
| 丙 | 13.3 | 31.6 | 63.9 | 110 | 169 | |
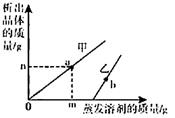

溶质质量分数 | 5% | 10% | 15% | 20% | 26% |
溶液密度(g/cm3) | 1.03 | 1.07 | 1.10 | 1.15 | 1.20 |
请回答下列问题:
盐溶液多少千克?需加多少体积的水?
下表是碳酸钠的部分溶解度数据
温度/℃ | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
溶解度/g | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 | 45.1 | 44.7 |

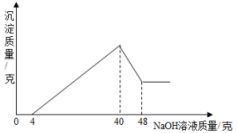
(提示:Al(OH)3+NaOH=NaAlO2+2H2O,NaAlO2易溶于水)
