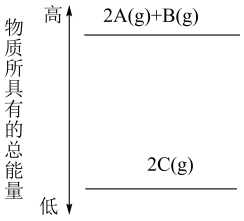
①如图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“-”。
②写出表示丙烷燃烧热的热化学方程式:。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为。
①P4(s,白磷)+5O2(g)=P4O10(s) ΔH1=-2 983.2 kJ·mol-1
②P(s,红磷)+ O2(g)=
P4O10(s) ΔH2=-738.5 kJ·mol-1
则白磷转化为红磷的热化学方程式为。相同的状况下,能量较低的是;白磷的稳定性比红磷(填“高”或“低”)。
Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)=2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH=kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式。
WO2(s)+2H2(g) W(s)+2H2O(g) ΔH=+66.0 kJ·mol-1
WO2(g)+2H2(g) W(s)+2H2O(g) ΔH=-137.9 kJ·mol-1
则WO2(s) WO2(g)的ΔH=。