(2)
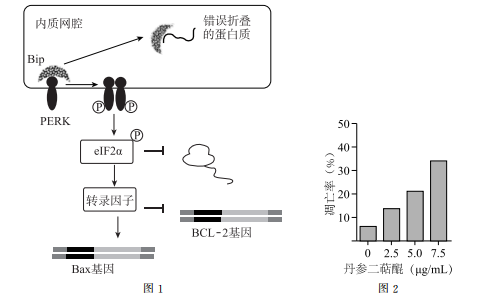
正常情况下,内质网膜上的PERK与Bip结合后保持失活状态。但当细胞受到一定刺激后,内质网腔内积累大量错误折叠的蛋白质,扰乱细胞内环境,导致如图1所示内质网应激(ERS)的一系列反应。由于错误折叠蛋白质对Bip的亲和力PERK对Bip的亲和力,使PERK发生磷酸化被激活,p-PERK(磷酸化PERK)促进eIF2α的磷酸化,进而阻止新生蛋白质的合成,这是调节机制。在持续而严重的ERS条件下,p-eIF2α(磷酸化eIF2α)还促进有关转录因子的合成,通过调节相关基因的,降低抗凋亡蛋白BCL-2的含量,提高促凋亡蛋白Bax的含量,诱导受损细胞凋亡。