|
成分 |
含量/(mg/L) |
成分 |
含量/(mg/L) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
| 142 |
| | 2560 | Br- | 64 |
| Mg2+ | 1272 |
电渗析法淡化海水示意图如图所示,其中阴(阳) 离子交换膜仅允许阴(阳)离子通过。

①电解氯化钠溶液的离子方程式。
②电解过程中阴极区碱性明显增强,用平衡移动原理 解释原因。 在阴极附近产生少量白色沉淀,其成分有和CaCO3。
③淡水的出口为(填“a”、“b”或“c”);a 出口物质为(填化学式)。
④若用下面燃料电池为电源电解 100mL1mol•L-1 氯化钠溶液,当电池消耗0.00025 molO2 时,常温下,所得溶液的 pH 为(忽略反应前后溶液体积变化)
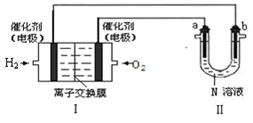
①Ⅰ中通入O2的一端为电池的极。 通入H2的一端的电极反应式
②若在Ⅱ中实现锌片上镀铜,则 b 的电极材料是,N 溶液为溶液。
③若在Ⅱ中实现 Cu+H2SO4= CuSO4+H2↑,则a 极的反应式是,N 溶液为 溶液。
| n( | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液的 pH 降至约为 6 时,送至电解槽再生。再生示意图如下,结合图示回答:
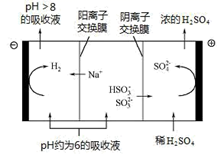
① 在阳极放电的电极反应式是。
②当阴极室中溶液 pH升至 8 以上时,吸收液再生并循环利用。简述再生原理:。