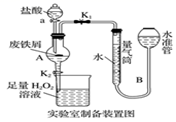
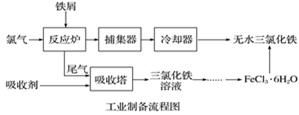
已知:①无水FeCl3的熔点为555K、沸点为588K。
②废铁屑中的杂质不与盐酸反应。
③不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
实验室制备操作步骤如下:
I.打开弹簧夹K1 , 关闭活塞K2 , 并打开活塞a,缓慢滴加盐酸;
II.当装置A中不产生气泡时,关闭弹簧夹K1 , 打开活塞K2 , 当A中溶液完全进入烧杯后关闭活塞a;
III.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
①滴定终点的现象是;
②样品中氯化铁的质量分数为。