①230℃,向容器中投入0.5molCO2和1.5molH2 , 当转化率达80% 时放出热量19.6kJ能量,写出该反应的热化学方程式。
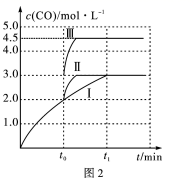
②一定条件下,往 2L恒容密闭容器中充入1.0molCO2和3.0molH2 , 在不同催化剂作用下,相同时间内 CO2的转化率随温度的变化如图1所示:

催化剂效果最佳的是催化剂(填“Ⅰ”“Ⅱ”“Ⅲ”)。b点v( 正 )v( 逆 )( 填“>”“<”或“=”) 。此反应在 a 点时已达平衡状态,a 点的转化率比 c 点高的原因。已知容器内的起始压强为100kPa,则图中c点对应温度下反应的平衡常数Kp=KPa-2 。(保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)