[探究一]比较金属活动性
[实验方案]如图所示,向四支试管中分别加入等体积等质量分数的稀硫酸,分别放入相同形状大小的锌片、铁片、铜片,铁片与铁粉质量相等。
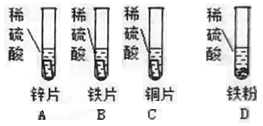
[实验现象]试管A、B、D中均产生气泡,C中无明显现象。
老师告诉同学们,铜在一定条件 下能与硫酸反应。同学们在老师的帮助下继续实验。取大小相同的光亮铜片,依次加入配制好的不同浓度的硫酸中,用酒精灯充分加热,观察到的现象如下表所示。
铜片与不同浓度硫酸溶液加热后的实验现象
|
浓度 |
31% |
43% |
54% |
63% |
|
实验现象 |
加热20min,铜片表面光亮 |
加热20min,铜片表面光亮 |
加热20min,铜片表面光亮 |
加热20min,铜片表面光亮 |
|
浓度实验 |
72% |
81% |
86% |
92% |
|
现象 |
加热9min后,铜片表面开始变黑,20min时反应剧烈 |
加热5min后,铜片表面开始变黑,10min时反应剧烈 |
加热3min后,铜片表面开始变黑,10min时反应剧烈 |
加热2min后,铜片表面开始变黑,5min时反应剧烈 |
|
铜片表面都有很多气泡产生,同时产生刺激性气味的气体,溶液变成蓝色 |
||||
根据表格中反应现象,铜与硫酸会生成水和,(填化学式)。
分析表格,请写出铜与硫酸发生反应的条件:。