1.
(2020高二下·靖远期末)
某实验小组先用如图所示装置制备FeSO4溶液,再与等物质的量的(NH4)2SO4反应,制备补血剂硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]。已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
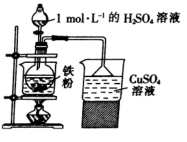
实验步骤如下:
①称取0.7g铁粉,用10mL10%Na2CO3溶液煮沸洗净,加入烧瓶中,再加入10 mL1 mol/LH2SO4溶液反应。
②保持温度在70~80℃之间,至反应无明显气泡产生,停止加热,过滤,称量残余固体质量。
③向FeSO,溶液中加入一定质量的(NH4)2SO4固体,在70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。用95%的酸性乙醇溶液洗涤晶体两次,用滤纸吸干,即可得到硫酸亚铁铵晶体。
回答下列问题:
-
(1)
图中盛装1mol/L的H2SO4溶液的仪器名称是,若用98%的浓硫酸来配制100 mLH2SO4溶液,需要用到的玻璃仪器有烧杯玻璃棒、量筒、、。图示装置中的加热方式是。
-
-
(2)
由于加入的铁粉不纯,反应过程中会产生少量PH3气体,因此需使用封闭装置。用CuSO4溶液吸收PH3时会有磷酸和一种紫红色固体生成,则该反应的化学方程式为。
-
-
(3)
铁粉和硫酸采取步骤①中的配比关系的主要原因是。
-
-
(4)
步骤②中,为避免在过滤时析出FeSO4晶体,可采取的措施是。
-
-
(5)
步骤③将溶液趁热倒入50 mL乙醇中,该操作的目的是。
-
-
(6)
已知酸性高锰酸钾溶液可与Fe
2+发生氧化还原反应:

+5Fe
2++8H
+=Mn
2++5Fe
3++4H
2O。现称取3.30g(NH
4)
2Fe(SO
4)
2·6H
2O (相对分子质量为392)产品(杂质只有FeSO
4·7H
2O,相对分子质量为278)溶于稀硫酸中,然后用0.10mol/L的酸性高锰酸钾溶液滴定,达到终点时消耗了18.00mL酸性高锰酸钾溶液。
①滴定终点时的现象是。
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为(保留4位有效数字)。
-
