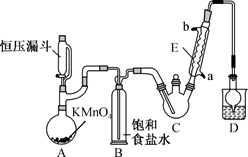
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸)
③相关物质的相对分子质量及部分物理性质:
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| C2H5OH | 46 | ﹣114.1 | 78.3 | 与水互溶 |
| CCl3CHO | 147.5 | ﹣57.5 | 97.8 | 可溶于水、乙醇 |
| CCl3COOH | 163.5 | 58 | 198 | 可溶于水、乙醇、三氯乙醛 |
| C2H5Cl | 64.5 | ﹣138.7 | 12.3 | 微溶于水,可溶于乙醇 |