1.
(2021·张家口模拟)
利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢,再与一氧化碳反应制甲醇、甲醚。发生的反应有:
Ⅰ.2H2(g)+CO(g)  CH3OH(g) ΔH1=-90.8kJ∙mol-1
CH3OH(g) ΔH1=-90.8kJ∙mol-1
Ⅱ.2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ∙mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ∙mol-1
Ⅲ.CO(g) +H2O(g)  CO2(g)+H2(g) ΔH3=-41.3kJ∙mol-1
CO2(g)+H2(g) ΔH3=-41.3kJ∙mol-1
-
(1)
反应3H
2(g)+3CO(g)

CH
3OCH
3(g)+CO
2(g)的Δ
H=
。
-
-
(2)
在恒温条件下,将2 molH
2和1 mol CO投入到刚性容器中,发生反应Ⅰ,下列说法正确的是___________(填选项序号)。
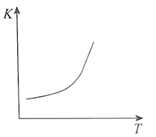
A . 当容器中混合气体的密度不再变化时反应达到平衡状态
B . 反应放出的热量小于90.8kJ
C . 如上图可表示该反应平衡常数随温度的变化
D . 平衡后,再充人2molH2和1molCO,再次达到平衡,H2和CO的体积分数均减小
-
-
(3)
在工业生产中,生产设备需保持一定的温度和压强,请写出一种能提高反应Ⅰ中CO转化率的方法:。
-
-
(4)
将组成为2∶1的H
2和CO充入恒温密闭容器中,分别在36MPa和54MPa恒压条件下发生反应Ⅰ。实验测得不同温度下CO的平衡转化率(α)随温度(
T)变化示意图如图所示:

①600℃,54MPa时a点v正v逆;
②计算600℃,36MPa时该反应的平衡常数Kp=Mpa-2(Kp为用气体的平衡分压代替物质的量浓度计算的平衡常数)。
-
-
(5)
为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图所示。CO转化率随温度变化的规律是
,其原因是
。

-
CH3OH(g) ΔH1=-90.8kJ∙mol-1
CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ∙mol-1
CO2(g)+H2(g) ΔH3=-41.3kJ∙mol-1


