[查阅资料]
Ⅰ、碱石灰是氢氧化钠与氧化钙的固体混合物。
Ⅱ、无水硫酸铜是一种白色固体,遇水会变成蓝色。
[设计实验]同学们用图1所示装置测定反应后生成CO2的质量(装置气密性良好,浓硫酸、碱石灰均足量)。称取一定质量的样品于锥形瓶中,通入一段时间空气后,向样品中滴加稀硫酸,待样品反应完全,继续通入一段时间空气后,测出生成CO2的质量,计算。

①图1中,装置A中反应化学方程式为(写出一个即可);浓硫酸的作用是。待样品反应完全,继续通入一段时间空气,目的是。为测出生成CO2的质量,需要在样品反应前后分别称量装置(填裝置序号)的质量。
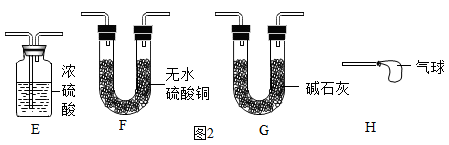
②小红同学认为图1装置设计还存在一个明显敏陷,可增加图2中的装置进行改进,改进后整套装置的连接顺序为(按气流方向填装置序号)。
③小青同学认为图1中如果没有D装置,测得该固体中Na2 CO3的含量会偏大,原因是。
[反思与评价]设计实验方案应使实验简便、误差小。
[查阅资料]Fe3O4为黑色粉末,能与盐酸反应,生成FeCl2和FeCl3 , 含有Fe3+的盐溶液遇到硫氰化钾(KSCN)溶液时变成红色。
[实验探究]取一定量的固体于试管中,加足量的盐酸,充分反应后有部分固体溶解,则黑色固体中一定含有。过滤,得到滤液A,并对滤液A的成分进行如下探究:
实验操作 | 实验现象 | 实验结论 |
实验1:取一定量滤液A于试管中,插入银白色铁丝 | 铁丝上无红色固体析出 | 该固体物质一定没有 |
实验2: | 滤液A中一定还含有的物质是氯化铁 |
通过实验判断该固体物质一定还含有Fe3O4 , 写出Fe3O4与盐酸反应的化学方程式:。