
①第Ⅰ阶段的平衡常数为(保留2位有效数字)。
②比较第Ⅱ阶段和第Ⅲ阶段平衡常数的大小:(填“>”“<”或“=”)。
化学吸附:;
;
表面反应:;
;
脱附:
其中,的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。下列说法正确的是。
A.控制温度400~-500℃远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.实际工艺中原料中和
物质的量之比为1∶2.8,氮气过量除了提高氢气的转化率,还可以提高整体反应速率
C.基于分子间有较强分子间作用力可将其液化,不断将液氨移去,有利于反应正向进行
D.、
的混合气只需一次通过合成塔
②我国科学家以为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。
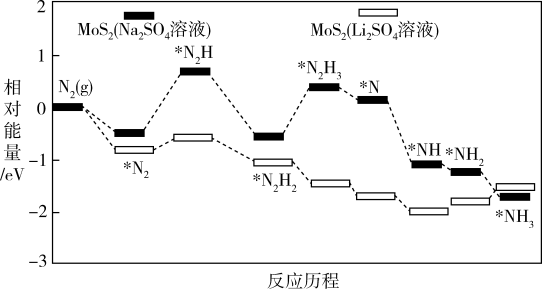
在(填“
”或“
”)溶液中催化效果更好:在
溶液与
溶液中,反应
中的
(填“前者大”“后者大”或“一样大”)。