1.
(2022高三上·浙江开学考)
某研究小组用印刷电路板的腐蚀废液(主要含CuCl2、FeCl2、FeCl3)制备Cu(NH4)2SO4•H2O和FeCl2•4H2O。
I.制备流程图
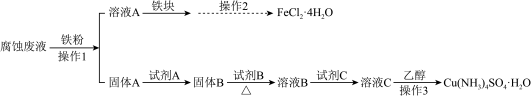
已知1.所加试剂均足量,且部分步骤有省略。
II.Cu(NH4)2SO4•H2O晶体纯度测定
①取a g Cu(NH4)2SO4•H2O晶体,加入适量1 mol·L-1稀硫酸,加热,待溶液冷却后配制成250 mL溶液。
②取25.00 mL溶液,加水50 mL,调节溶液至弱酸性(pH=3~4),加入过量20%KI溶液,避光静置几分钟。
③用c mol·L-1Na2S2O3标准溶液滴定至溶液呈淡黄色,再加入淀粉溶液,继续滴定至溶液变浅蓝色,再加入一定量10%KSCN溶液,蓝色变深,继续滴定至蓝色刚好消失,记录消耗Na2S2O3标准溶液的体积。
④平行滴定三次,消耗Na2S2O3标准溶液的平均体积为V mL。
已知2:①2Cu2++4I-=2CuI↓+I2;I2+2 =
= +2I-。
+2I-。
②CuI和CuSCN均为白色固体;Ksp(CuI)=1.1×10-12 , Ksp(CuSCN)=4.8×10-15。
请回答:
-
(1)
下列说法正确的是____。
A . 操作2通过蒸发至出现晶膜后趁热过滤,快速冷却滤液结晶,可得较大FeCl2•4H2O晶体
B . 可用KSCN或K3[Fe(CN)6]溶液检验FeCl2•4H2O晶体中是否存在杂质Fe3+
C . 溶液C中加入乙醇可以降低Cu(NH4)2SO4•H2O在溶剂中的溶解性,促进晶体析出
D . 溶液B中逐滴滴加试剂C至过量的过程中先出现蓝色沉淀后变为深蓝色溶液,这一现象可以说明与Cu2+结合能力大小为:NH3>OH->H2O
-
-
(2)
测定晶体纯度时,步骤②用KI溶液测定铜含量时,需在弱酸性(pH=3~4)溶液中进行的原因。
-
-
(3)
下列关于滴定分析的描述,正确的是____。
A . 加入过量20%KI溶液可以增大I2的溶解性,减少实验滴定误差
B . Na2S2O3标准溶液应盛放在碱式滴定管中
C . 滴定时,眼睛应一直观察滴定管中溶液体积的变化
D . 若滴定恰好完全时,滴定管尖端悬半滴未滴下,会导致测定结果偏低
-
-
(4)
结合离子反应方程式并用必要的文字说明滴定过程中加入KSCN溶液的作用。
-
-
(5)
Cu(NH4)2SO4•H2O(M=246 g•mol-1)晶体样品的纯度为%(用含a、c、V的代数式表示)。
-

=
+2I-。