方法一:在低温、加压条件下,将空气液化。然后将温度升高至-196℃~-183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。
从构成物质的微粒视角分析,在方法一空气液化过程中,主要改变的是。
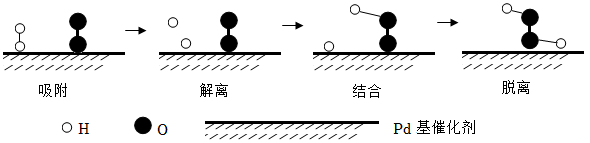
“解离”时,结构被破坏的分子是(填化学式)。
ⅰ.小组同学不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表1。
表1探究温度、反应物的浓度对反应速率的影响
50℃ | 60℃ | 70℃ | |
5%(H2O2) | 无明显气泡 | 无明显气泡 | 极少量气泡 |
10%(H2O2) | 无明显气泡 | 无明显气泡 | 少量气泡 |
15%(H2O2) | 无明显气泡 | 少量气泡 | 较多气泡 |
由表1可知: 温度或反应物浓度可加快 H2O2的分解。
资料:常见可溶性氯化物在水溶液中大都是以阳离子和氯离子形式分散的。
表2探究氯化物对反应速率的影响
实验1 | 实验 2 | 实验 3 | |
氯化物的种类 | NaCl | MgCl2 | CuCl2 |
氯化物的质量 | 0.1 g | a g | 0.1 g |
放出氧气的体积/mL | 2.0 | 4.0 | 420.0 |
双氧水的分解率/% | 0.30 | 0.60 | 63.18 |
在表2中,a的值为;
用双氧水可制得“钙多宝”。“钙多宝”主要成分是CaO2 , 常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是Ca(OH)2和CaCO3。
请用符号表达式说明出现上述杂质的原因:;。