氢氧化钠的部分溶解度如表所示。
温度(℃) | 10 | 20 | 30 | 40 | 60 |
溶解度(g/100g水) | 98 | 109 | 119 | 129 | 174 |
10℃时,氢氧化钠的溶解度是g/100g水。
向盛有20g、4%的氢氧化钠溶液中逐滴滴加稀盐酸,用pH传感器测定溶液pH随滴入稀盐酸体积的变化,如图1所示。
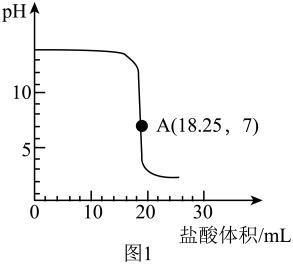
Ⅰ.氢氧化钠与盐酸反应的化学方程式是。
Ⅱ.结合数据说明,实验过程中A(18.25,7)点的含义。
分别取等体积的氢氧化钠溶液、稀盐酸、水,按如表进行实验,测定溶液温度随时间变化的曲线如图2所示。证明中和反应有热量放出的证据是。
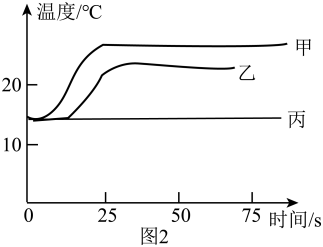
烧杯 | 烧杯中原有的物质 | 逐滴滴入的物质 |
甲 | 40%氢氧化钠溶液 | 4%稀盐酸 |
乙 | 40%氢氧化钠溶液 | 水 |
丙 | 4%稀盐酸 | 水 |