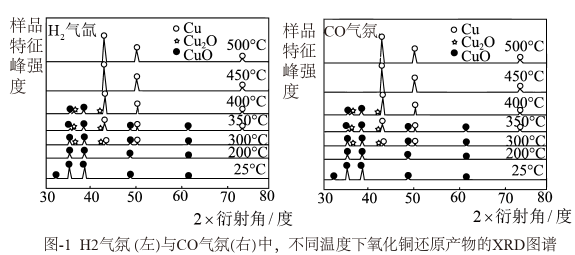
结合图像说明,(选填“能“或“不能”)采用热还原的方法直接制得纯净的Cu2O产品,原因是。

【查阅资料】
Ⅰ.木炭能在较高温度环境中将氧化铜中的氧元素夺去,生成单质铜
Ⅱ.酒精灯防风罩能将酒精灯火焰温度提升至600~800℃
Ⅲ.铜的熔点为1083*C
【装置分析】
①该实验并未采用略向下倾斜试管的加热方法,原因可能是。
A.使火焰更好包裹住药品部位,提高反应温度
B.防止生成的气体冲散药品,降低实验成功率
C.过程中会生成液态的铜,且防止石灰水倒吸
【实验过程】
实验:取0.1g木炭粉与一定量的氧化铜粉末按下表所示比例充分混合,在粉末堆中插入一块灼烧过的铜片,进行实验。
序号 | 木炭粉与氧化铜粉末混合质量比 | 充分反应后试管底部固体的颜色 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有少量黑色物质 | |
②从表中可知,木炭还原氧化铜的最佳质量比是。
③无需再进行木炭粉与氧化铜粉末质量比为1:14的实验,原因是。
④取出铜片观察,发现埋入粉末的部分变红,有金属光泽,上方铜片也变为亮红色,右侧澄清石灰水变浑浊,由此推测反应中产生的气体一定有。
⑤试管底部的亮红色固体呈“海绵状”,如图-3所示,结合以上信息,实验得到“海绵铜”而非块状铜的原因是。
⑥某同学取8.0gCuO固体粉末与一定量木炭以最佳质量比混合,若CuO完全转化为Cu,理论上预计能得到Cu的质量为(写出计算过程)。