②1/2N2(g)+1/2O2(g)=NO(g) △H2=-89.75kJ/mol
③2NO(g)+O2(g)=2NO2(g) △H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为。
①0~10min内,CO的平均反应速率v(CO)=;
②若容器中观察到 ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡(填“右移”或“左移”或“不移动”)。
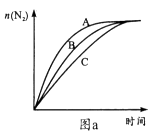
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
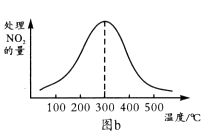
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因(假设该温度范围内催化效率相同)。