 B . 干燥氨气
B . 干燥氨气  C . 分离稀硫酸与硝基苯的混合物
C . 分离稀硫酸与硝基苯的混合物  D . 制取并收集SO2
D . 制取并收集SO2
Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )

选项 | 实验操作 | 实验现象 | 结论 |
A | 向蛋白质溶液中滴加CuSO4溶液 | 有固体析出 | 蛋白质发生盐析 |
B | 向浓度均为0.10 mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
C | 取等物质的量的Al和Fe,分别与足量的盐酸反应 | Al产生的氢气多 | 金属性:Al>Fe |
D | 向苯酚浊液中滴加饱和Na2CO3溶液 | 浊液变澄清 | 酸性:苯酚>碳酸 |
 C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中
C . 常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 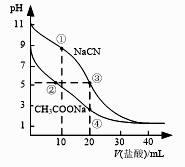
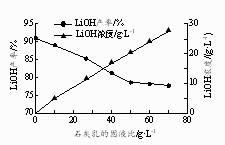
②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1 , 若固液比过低对后续操作的不利影响是。
①LiOH·H2O中常含有少量的Li2CO3 , 但该物质对所制Li2O得纯度无影响,其原因是。
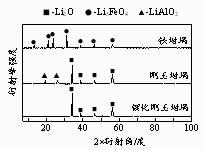
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是。铁坩埚中发生反应的化学方程式为。
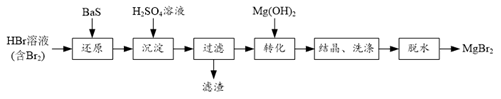
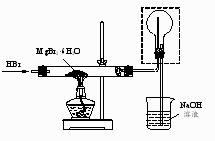
①通入HBr的目的是。
②图中框内装置的作用是。
②检验FeCO3已经洗涤干净的操作为。

①分子中只有3种不同化学环境的氢;
②能发生银镜反应,苯环上的一取代物只有一种。
请写出以 ![]() 和CH3NO2为原料制备
和CH3NO2为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4 , 同时产生NO。该反应的离子方程式为。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O ):c(HC2O
)=。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
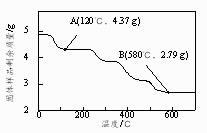
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)(写出计算过程)。
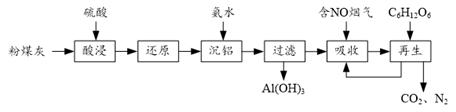
②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是。
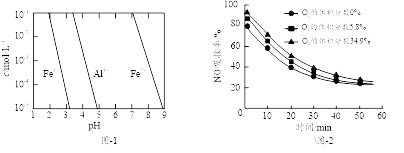
①为提高烟气中NO 的吸收率,可采取的措施有(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为。
①该装置工作时,电极A作极。
②熔融粗铝时加入铜的作用是。

