CuSO4•5H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42﹣(aq) 热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
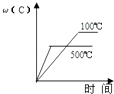 B .
B . 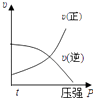 C .
C . 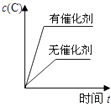 D .
D . 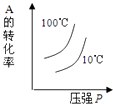

温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
 向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图
B .
向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图
B .  向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图
C .
向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图
C .  密闭容器中进行N2(g)+3H2(g)⇌2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图
D .
密闭容器中进行N2(g)+3H2(g)⇌2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图
D .  密闭容器中进行CH3OCH3(g)+3H2O(g)⇌6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图
密闭容器中进行CH3OCH3(g)+3H2O(g)⇌6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图

a.升高温度 b.充入1mol He气c.再充入1mol CO和2mol H2d.使用催化剂.
实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
① | 常温 | 1 | 20 | 50 | 30 | t1 |
② | 常温 | 2 | 20 | 50 | 30 | t2 |
③ | 常温 | 2 | 40 | a | b | t3 |
表中a、b的值分别为:a=、b=
实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
若反应混合液褪色时间小于实验①中的t1 , 则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
V mL.请回答下列问题:
①该测定方法中(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=mol/L.(请写出最后化简结果)