






已知:
①纯ClO2易分解爆炸,空气中ClO2的体积分数在10%以下比较安全。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O;高于38℃时析出NaClO2;高于60℃时NaClO2分解成NaClO3和NaCl。
a.石蕊
b.酚酞
c.pH试纸
d.pH计
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2 , 当消耗标准状况下3.36L CO时,放出的热量为kJ(用含有a和b的代数式表示)。

①0~20 min内,v(N2O4)=mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为。改变温度至T1时k1=k2 , 则T1373K(填“>”、“<”或“=”)。
①若V=100,则所得溶液中c(H2N2O2)c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因。
②若V=200,则所得溶液中离子浓度由大到小的顺序为。
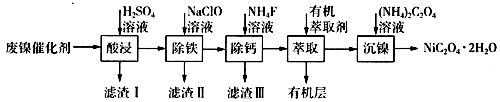

①若控制温度40℃、pH=8,则滤渣II的主要成分为(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:。
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要。
②该镀镍试剂的化学式为。

①组成M的元素中,电负性最大的是(填名称)。
②M中碳原子的杂化方式为。
③M中不含(填代号)。
a.π键
b.σ键
c.离子键
d.配位键

①A、B、C、D 4种微粒,其中氧原子是(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,,);钛氧键的键长d=(用代数式表示)。
