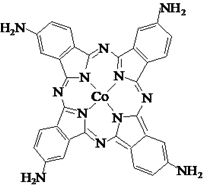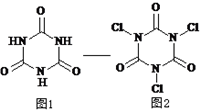
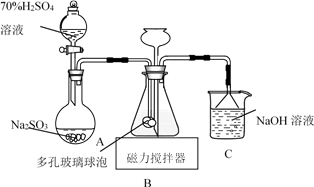
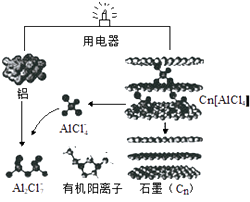
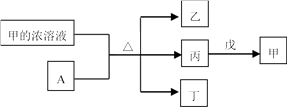
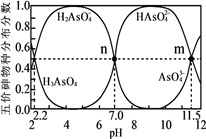
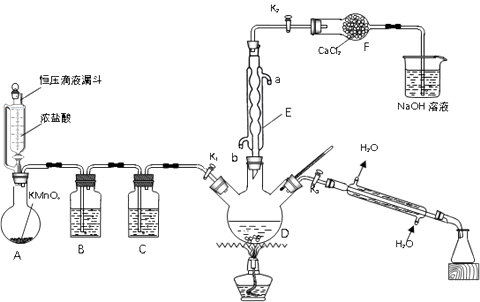
回答下列问题:
物质 | 溶解性 | 熔点(℃) | 沸点(℃) |
甲苯 | 极微溶于水,能与乙醇、乙醚等混溶 | -94.9 | 110 |
氯化苄 | 微溶于水,易溶于苯、甲苯等有机溶剂 | -39 | 178.8 |
二氯化苄 | 不溶于水,溶于乙醇、乙醚 | -16 | 205 |
三氯化苄 | 不溶于水,溶于乙醇、乙醚和苯 | -7 | 220 |
①称取13.00g样品于烧杯中,加入50.00mL 4 mol•L-1 NaOH水溶液,水浴加热1小时,冷却后加入35.00mL 40% HNO3 , 再将全部溶液转移到容量瓶中配成100mL溶液。取20.00mL溶液于试管中,加入足量的AgNO3溶液,充分振荡,过滤、洗涤、干燥,称量固体质量为2.87g,则该样品的纯度为%(结果保留小数点后1位)。
②实际测量结果可能偏高,原因是。
编号 | 加料量(CaCl2/Ge) | 母液体积 (mL) | 过滤后液含锗(mg/L) | 过滤后液 pH | 锗沉淀率(%) |
1 | 10 | 500 | 76 | 8 | 93.67 |
2 | 15 | 500 | 20 | 8 | 98.15 |
3 | 20 | 500 | 2 | 11 | 99.78 |
4 | 25 | 500 | 1.5 | 12 | 99.85 |
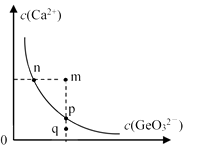
a.n点与p点对应的Ksp相等
b.通过蒸发可以使溶液由q点变到p点
c.q点无CaGeO3沉淀生成
d.加入Na2GeO3可以使溶液由n点变到m点

①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJ•mol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g) CH4(g)+2H2O(g) △H=kJ•mol-1。
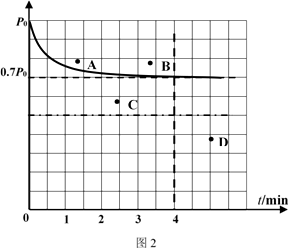
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2 , 控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为;温度T1 下,该反应的化学平衡常为。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是(填字母)。
①能发生银镜反应;②分子结构中含有—NH2;③苯环上有两个取代基,且苯环上的一氯代物有2种。若满足①②条件,且苯环上的一氯代物只有1种,则其中一种物质的结构简式为。
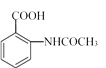 ,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)。
,参照上述合成过程,写出相应的合成路线流程图(无机试剂任选)。