



弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①向NaCN溶液中通入少量CO2 , 发生的离子反应为。
②等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数的关系是:HCOONaNaCN。(填“>”、“<”或“=”)

①常温时醋酸的电离常数为1.96×10-5 , 0.10 mol·L-1CH3COOH溶液中c(H+)=mol·L-1。
②在①所示的溶液中溶质为
③在①和②所示溶液中c(CH3COO-)-c(CN-)(填“>”、“<”或“=”)c(HCN)-c(CH3COOH)。

滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为。(ICl3相对分子质量为233.5)
![]()
其中焙烧是将食盐和钒铅矿在空气中焙烧,这时矿石中所含的V2O5就转化为NaVO3 , 然后用水从烧结块中浸出NaVO3 , 再用稀硫酸酸化就得到V2O5的水合物,经过煅烧就可得到V2O5。
①配料在焙烧前磨碎的目的是。
②写出焙烧过程中V2O5发生反应的化学方程式:。

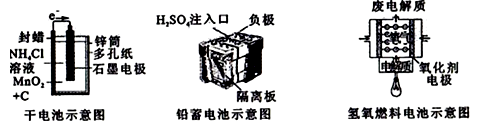
根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa.该反应的平衡常数表达式为,等于。
②平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。
