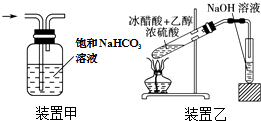


①都是主族元素,最外层电子数都大于4;
②单质在反应中都只能作氧化剂;
③氢化物常温下都是气态;
④氧化物常温下都可以与水反应生成酸.其中不正确的有( )
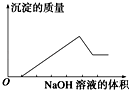
①B2+>A+>C﹣>D2﹣
②C﹣>D2﹣>A+>B2+
③B2+>A+>D2﹣>C﹣
④D2﹣>C﹣>A+>B2+
四种离子的半径由大到小及四种元素的原子序数由大到小的顺序分别是( )
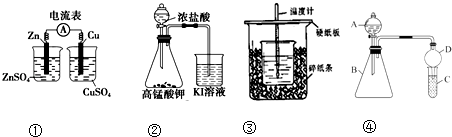
实验 金属 | G | L | M | R |
和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
根据表中所给实验结果,判断这四种金属活动性由强到弱的次序正确的是( )
![]()
物质 | 金刚石 | 石墨 |
外观 | 无色,透明固体 | 灰黑,不透明固体 |
熔点 | ? | ? |
燃烧热/KJ•mol﹣1 | 395.4 | 393.5 |
 D . 由表中信息可推知相同条件下金刚石的熔点高于石墨的
D . 由表中信息可推知相同条件下金刚石的熔点高于石墨的
 锌锰电池
B .
锌锰电池
B .  氢燃料电池
C .
氢燃料电池
C .  铅蓄电池
D .
铅蓄电池
D .  镍镉电池
镍镉电池

元素 | Al | B | Be | C | Cl | F | Li |
电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
元素 | Mg | N | Na | O | P | S | Si |
电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
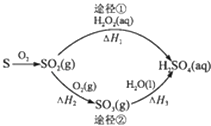
试结合元素周期律知识完成下列问题:
①根据上表给出的数据,可推知元素的电负性具有的变化规律是:同周期元素从左至右,电负性逐渐,同主族元素从上至下,电负性逐渐.
②预测元素电负性的大小关系:BrI,电负性最小的元素在周期表中的位置是(放射性元素除外).
③习惯上把SrI2作为离子化合物,把BaS作为共价化合物.(电负性Sr=0.95I=2.66Ba=0.89S=2.58)我们把两成键原子的电负性差值用△X表示,用△X的数值范围可判断离子键或共价键,试判断AlBr3中化学键的类型是.
锂 | X | Y | |
失去第1个电子 | 519 | 502 | 580 |
失去第2个电子 | 7296 | 4570 | 1820 |
失去第3个电子 | 11799 | 6920 | 2750 |
失去第4个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第2个电子时所需的能量要远远大于失去第1个电子所需的能量.
②表中X Y为第3周期元素,则X为,Y为.第3周期元素中,元素原子失去核外第一个电子需要的能量最多的是(均填元素符号).
①在含B的溶液中加入稀H2SO4 , 产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式
写出②中反应的化学方程式
|
编号 |
改变的条件 |
生成SO3的速率 |
|
① |
升高温度 |
|
|
② |
降低温度 |
|
|
③ |
增大氧气的浓度 |
|
|
④ |
使用催化剂 |
|
|
⑤ |
压缩体积 |
|
|
⑥ |
恒容下充人Ne |
|
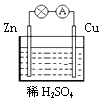
①负极材料是,负极发生(填“氧化”或“还原”)反应;正极反应式为.
②当导线中有1mol电子通过时,理论上发生的变化是(填序号). (相对原子质量:H1,Zn65)
a.溶液增重32.5g b.溶液增重31.5g
c.析出1g H2 d.析出11.2LH2

①m曲线表示锌与稀硫酸(填“X”或“Y”)反应.
②锌分别与稀硫酸X、Y反应时,反应速率不同的原因是(填序号).
a.CuSO4作催化剂
b.加入硫酸铜溶液增大了c(SO42﹣)
c.Zn首先与Cu2+反应,生成的Cu与Zn、稀硫酸构成原电池
d.加入硫酸铜溶液增大了溶液体积.