
 称量
B .
称量
B . 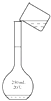 转移
D .
转移
D .  B .
B .  C .
C .  D .
D . 
A.在烧杯中溶解时,有少量液体洒出;
B.定容时,俯视刻度线;
C.转移时,容景瓶中有少量水.

请根据以上信息回答下列问题:


以下叙述正确的是 (双选)

①实验时为控制SO2产牛的快慢.应采取的措施是;
②烧杯中NaOH溶液的作用是;
③将燃着的Mg条迅速插入集满SO2的集气瓶中,发现Mg条继续燃烧,则反应后生成的含硫物质可能是(填化学式,写出一种即可).
④酸性KMnO4溶液可以吸收SO2 , 将其氧化而除去,自身被还原为Mn2+ , 写出该反应的离子方程式;
⑤试剂X是;
⑥当观察到,即证明H2SO3比H2CO3酸性强.

赤泥的主要成分为(写出化学式).
(已知:AlN+NaOH+H2O═NaAlO2+NH3↑)
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为多少?(写出计算过程)