 B .
B .  C .
C .  D .
D . 
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 稀硫酸 | Na2S | CuSO4溶液 | H2S酸性强于H2SO4 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | 亚硫酸钠 | 硝酸钡溶液 | 二氧化硫与可溶性钡盐均可生成白色沉淀 | |
| D | 浓硝酸 | 碳酸钠 | 硅酸钠溶液 | 酸性:硝酸>碳酸>硅酸 |


TiO2(s) + 2Cl2(g) = TiCl4(l) + O2(g) △H = +140.5 kJ/mol
C(s,石墨) + 1/2O2(g) = CO(g) △H = -110.5 kJ/mol
则反应TiO2(s) + 2Cl2(g) + 2C(s,石墨) = TiCl4(l) + 2CO(g) 的△H 是( )


已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
【制备NaClO溶液】实验装置如下图图甲所示(部分夹持装置已省略)
已知:3NaClO 2NaCl+NaClO3
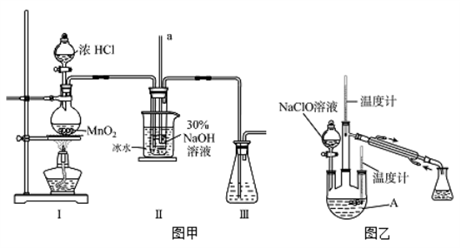
实验装置如上图图乙所示,反应过程中,如果分液漏斗中溶液的滴速过快, 部分N2H4·H2O参与A中反应并产生大量氮气,产品产率因此降低,请写出降低产率的相关化学反应方程式;充分反应后,加热蒸馏A内的溶液即可得到水合肼的粗产品。
称取馏分0.3000 g,加水配成20.0 mL溶液,一定条件下用0.1500 mol·L-1的I2溶液滴定。已知: N2H4·H2O + 2I2 = N2↑+ 4HI + H2O。
①滴定时,可以选用的指示剂为;
②实验测得消耗I2溶液的平均值为20. 00 mL,馏分中N2H4·H2O的质量分数为。
下列制备氢氧化铁胶体的操作方法正确的是____________(填字母);
其制备过程如下:

A.盐酸
B.氨水
第一步,准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,再滴入少量2 mol·L—1的H2SO4溶液,充分反应。
第二步,向上述锥形瓶中加入几滴淀粉溶液。
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液VmL。 (已知:I2+2S2O32-=2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是;
②CaO2的质量分数为(用字母表示)