 B . 中和热的测定
B . 中和热的测定  C . 加热熔融NaOH固体
C . 加热熔融NaOH固体  D . 测定高锰酸钾溶液的浓度
D . 测定高锰酸钾溶液的浓度 

下列说法错误的是( )


 和
和 



①已知图1所示反应每消耗1mol H2 , 热量变化是16.3KJ,则反应的热化学方程式为。曲线I、Ⅱ对应的平衡常数大小关系为K1K2(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有3个H—H断裂
③一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示。

当温度为470K时,图中P点(填“是”或“不是”)处于平衡状态。490K之后,甲醇产率下降的原因是。

则过程I中阴极电极反应式,工业上生产1.4×104g的LDPE,转移电子的物质的量为。

则第一步反应的离子方程式为。
①已知常温下,H2S的电离常数K1=1.0×10-7 , K2=7.0×10-15。0.1mo1·L-1NaHS溶液的pH7(填“>”“=”或“<”),理由是。
②已知25℃时KSP[Fe(OH)3]=4.0×10-38 , 此温度下若在实验室中配制5mo1·L-1100mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入mL 2mol·L-1的盐酸(忽略加入盐酸时溶液体积的变化)。
③FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2=Fe+2Li2S,正极反应式是。

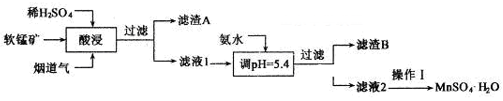
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O 第二步反应的离子方程式为。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如下图所示(超过50℃后溶液不会再变蓝)。根据图像,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:。

KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量mg·kg-1。