


(查阅资料)
① ![]()
②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化
CuCl+O2+ =3CuO·CuCl2·3H2O+HCl
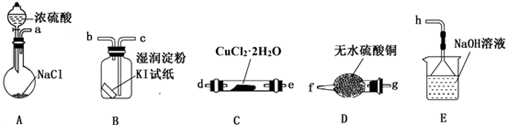
装置A用于制取HCl:NaCl+H2SO4=NaHSO4+HCl↑,浓硫酸在该反应中体现强酸性和性;
①连接装置,;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是;
装置B中试纸先变蓝后又褪色,经查资料获知过量的Cl2能将I2氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服Cl2过量的问题,但小组分析后认为该方案存在一个明显安全问题:
|
元素 |
相关信息 |
|
A |
A原子的1s轨道上只有1个电子 |
|
B |
B是电负性最大的元素 |
|
C |
C基态原子的2p轨道中有3个未成对电子 |
|
D |
D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
|
E |
E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl−取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为 (填序号)。
a.平面正方形
b.正四面体
c.三角锥形
d.V形

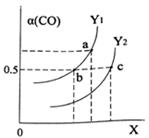
如图表示CO的平衡转化率(α)随温度和压强变化的示意图。X表示的是,Y1Y2(填“<”、“=”、“>”)。

①反应进行到4min时,v(正)v(逆)(填“>”“<”或“=”)。0~4min,CO2的平均反应速率v(CO2)=mol·L−1·min−1。
②该温度下平衡常数为。
③下列能说明该反应已达到平衡状态的是。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化

①操作Ⅱ所需的实验仪器为。
②过滤操作中玻璃棒使用的注意事项为。
③操作Ⅰ为沉淀的洗涤。请简述如何判断沉淀是否洗涤干净:。

①装置Ⅲ为冷凝管,则水流从进入。
②请用大写英文字母按从左到右顺序连接组装仪器。
③有同学指出②中连接的实验装置存在不足,不足之处为。