金属学 | Ti | Mg | Cu |
金属表面现象 | 放出气泡速度缓慢 | 放出气泡速度快 | 无变化 |

A | B | C | D |
向容量瓶中转移液体 |
实验室制取蒸馏水 |
从饱和食盐水中提取NaCl晶体 |
分离酒精和水 |
选项 | 足量 气体A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3•H2O电离出OH﹣ |

序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
① | Cl2 | FeBr2 | Cl﹣ | ||
② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
③ | KClO3 | 浓盐酸 | Cl2 |

A | B | C | D | |
实 验 | 实验分离水和酒精 | 用铵盐和碱制取氨气 | 用排空气法收集二氧化氮 | 用自来水制取蒸馏水 |
装置或仪器 |
|
|
|
|
 ,下列叙述正确的是( )
,下列叙述正确的是( )

下列说法正确的是( )
稳定性 | 粒子半径 | 熔点 | 键的极性 |
NH3H2O | O2﹣ Mg2+ | SO3 Na2O2 | H﹣O H﹣N |
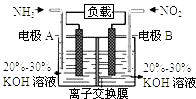
①放电时Na+向极迁移(填“a或b,”).
②放电时负极的电极反应式为:


填写下列空白:
①适量氯气 ②适量过氧化氢和稀盐酸
③酸性高锰酸钾溶液 ④氢氧化钠溶液.

【实验】在0.1mol•L﹣l MgSO4 , 0.05mol•L﹣l﹣Al2( SO4)3的混合溶液中滴加0.5mol.L﹣1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示.

推测l:生成Mg( OH)2沉淀,消耗OH ﹣;
推测2:;
推测3.
若推测l符合实际情况,则a点之前反应的离子方程式为一,请据此描述Mg( OH)2 , Al( OH)3两种物质在水溶液中溶解性的差异.
较大量存在的含金属元素的离子 | 检验方法 |