
| 检验操作 | 现象 | 结论 | |
| A | 加入盐酸酸化的氯化钡 | 产生白色沉淀 | 一定有 SO42- |
| B | 加入氯水与四氯化碳 | 有机层呈紫色 | 一定有 I- |
| C | 加入足量稀盐酸 | 产生无色气体 | 一定有 CO32- |
| D | 加入硝酸银 | 产生白色沉淀 | 一定有 Cl- |
 B .
B . 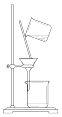 C .
C .  D .
D . 
下列说法正确的是( )

已知:氯化过程主要发生反应6Ca(OH)2 + 6Cl2 5CaCl2+Ca(ClO)2+6H2O
完成下列填空:
①; ②减少 Cl2 与 Ca(OH)2 之间的副反应。
|
加热次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
剩余固体质量(g) |
c |
d |
e |
e |
①进行加热操作时,应将固体置于(填仪器名称)中。
②该实验不必进行第五次加热的原因是。
③若某次测定结果的相对误差为-2.98%,写出导致这一结果的一种可能情况。