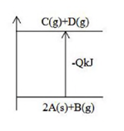

反应原理为B2O3(S)+3CaF2(S)+3H2SO4(浓)⇌2BF3(g)+3CaSO4(S)+3H2O(l)。
请完成下列填空:
A.三角锥形
B.平面正三角形
C.直线形
D.正四面体形
A.相互之间的置换反应
B.最高价氧化物对应的水化物的酸性
C.氢化物水溶液的酸性
D.相互形成的化合物中元素的化合价
实验室中在8L的密闭容器中进行该反应。
等浓度的上述四种物质的溶液pH值由大到小的是(用编号填写),选用这些物质中的部分,实现离子反应2H++SO32-→H2O+SO2↑,写出对应的化学方程式。某NaHSO3的浓度为c1 , pH为x1 , NaHSO4溶液的浓度为c2 , pH为x2 , 若x1<x2 , 则c1c2(填“>”或“<“或“=”)。
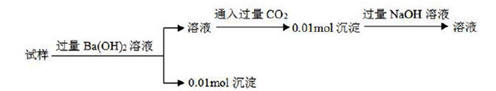
①取样品研碎置于(填仪器名称) 中加热灼烧到质量不再減少, 26.5g 样品最终变为白色粉末10.2g。实验过程中至少进行的称量次数为。
②另取相同质量的样品溶于中,加入足量硝酸银溶液取得沉淀,经洗涤、烘干、称量为28.7g,实验中检查沉淀是否洗浄的方法是。
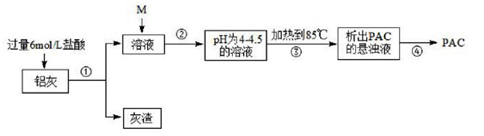
③列式汁算:x+y=3, =
请写出另一条比例式为。