 B . ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
B . ②分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸  C . ③分别向等质量且Mg和Zn中加入等质量、等浓度的稀硫酸
C . ③分别向等质量且Mg和Zn中加入等质量、等浓度的稀硫酸  D . ④分别向等质量的Mg和Zn中加入等质量、等浓度且定量的稀硫酸
D . ④分别向等质量的Mg和Zn中加入等质量、等浓度且定量的稀硫酸 

 玻璃烧杯
B .
玻璃烧杯
B .  铁架台
C .
铁架台
C .  橡胶塞
D .
橡胶塞
D . 
其主要反应原理如下:
①4FeWO4+4Na2CO3+O2 4Na2WO4+2Fe2O3+4CO2
②Na2WO4+2HCl(热浓)=H2WO4+2NaCl
③H2WO4 H2O+WO3
④3H2+WO3 W+3H2O
下列说法错误的是()
实验目的 | 实验方法 | |
A | 除去铜粉中混有的少量碳粉 | 在空气中充分灼烧 |
B | 除去FeCl2溶液中的少量CuCl2 | 加入过量的铁粉、过滤 |
C | 除去水中的空气 | 将水煮沸 |
D | 除去CO2中混有的少量CO | 将气体通过灼热的氧化铜 |

C与D的反应:;B转化为A的反应:
C转化为A的反应:该反应属于反应(填基本反应类型)。

①氢气在点燃前一定要。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为L。
电解时,水中需加入少量的NaOH,其作用是。通电一段时间后,发现甲、乙两量中筒收集的气体体积比略小于1:2,其原因可能是(写出一条即可)。

他让水蒸气通过一根烧红的铁质枪管,结果得到了氧气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为。

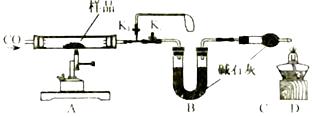
装置A中的玻璃管和其中物质在反应前后的质量差为m1 , 装置B和其中物质在反应前后的质量差为m2 , 据此可计算出水中O、H元素的质量比为(用含m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是(写出一条即可)。
方式一:2SO2+O2+2CaO═2CaSO4 方式二:2SO2+O2+4NaOH═2Na2SO4+2H2O
试计算:
(已知:CaSO4的价格为700元/吨,相对分子质量为CaSO4 136 Na2SO4 142)。