
①Al ②Al2O3 ③NaHCO3 ④Al(OH)3
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加BaCl2溶液,有白色沉淀生成,加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 | 该溶液中一定含有CO32- |
| D | 向某溶液加NaOH并微热,产生能使湿润红色石蕊试纸变蓝的无色气体 | 该溶液中一定含有NH4+ |


 ,下列说法正确的是( )
,下列说法正确的是( )

元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.186 | 0.160 | 0.143 | 0.112 | 0.104 | 0.099 | 0.066 |
主要化合价 | +1 | +2 | +3 | +4 | +6、-2 | +7、-1 | -2 |
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
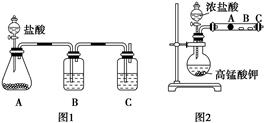
A中锥形瓶装入的是碳酸钙固体,A中发生的离子方程式为:,
B应放入的物质是,其作用为;
C中是Na2SiO3溶液该反应的离子方程式为。
如果A处的棉花由白色变成棕色,则A处的离子方程式为B处的现象是 。

①配制时,应用托盘天平称取NH4NO3的质量为;
②定容时俯视刻度线,所配得溶液的浓度(填“偏高”、“偏低”或“无影响”);