| | | | | ||||
| A. | 取粗盐 | B. | 溶解 | C. | 过滤 | D. | 蒸发结晶 |


|
元素 |
相对原子质量 |
元素 |
相对原子质量 |
元素 |
相对原子质量 |
|||
|
符号 |
名称 |
符号 |
名称 |
符号 |
名称 |
|||
|
Ag Al Ba C Ca Cl Cu |
银 铝 钡 碳 钙 氯 铜 |
108 27 137 12 40 35.5 64 |
Fe H He Hg K Mg Mn |
铁 氢 氦 汞 钾 镁 锰 |
56 14 201 39 24 55 |
N Na O P S Si Zn |
氮 钠 氧 磷 硫 硅 锌 |
14 23 16 31 32 28 65 |
①表中有 种金属元素。
②表中元素可组成的稀有气体是 (写化学式)。
③金刚石和石墨都是由 元素组成的单质,互称为。
④SiO2 是制造玻璃、光导纤维、光学仪器等的原料。SiO2 中 Si 元素的化合价是;Si、O 原子物质的量之比是;查表计算 SiO2 的摩尔质量为 g/mol;1molSiO2 中约含个 Si 原子(用科学记数法表示)。
①KNO3 属于(填“酸”、“碱”或“盐”)。
②KNO3 进行焰色反应,透过蓝色钴玻璃观察到火焰呈色。
③下表是 KNO3 在不同温度时的溶解度。
|
温度(℃) |
30 |
40 |
50 |
60 |
70 |
80 |
|
溶解度(g/100g 水) |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
I. 30℃时,KNO3 的溶解度是g/100g 水。
II. 50℃时,KNO3 溶液溶质质量分数的最大值是(只列出表达式)。
III. 80℃时,将一定质量的 KNO3 溶液按图示进行操作:
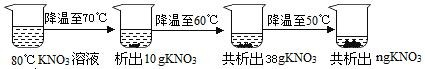
80℃时的 KNO3 溶液是(填“饱和”或“不饱和”)溶液。图中 n 的数值为。
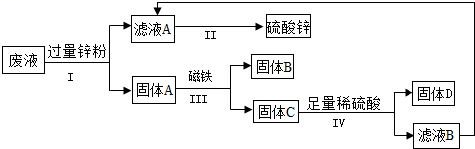
①步骤 I、IV 包含的相同操作是。
②写出步骤 I 中反应的化学方程式。
③上述步骤(选填步骤编号)所包含的反应体现了锌的活动性比铜强。
④要计算废液中硫酸铜质量,必须要称量的质量。(实验过程中的物质损失忽略不计)
⑤判断步骤 IV 中加入的稀硫酸足量的方法是。
①该大理石中碳酸钙的物质的量。(根据化学方程式列式计算)
②该大理石中碳酸钙的质量分数。

①写出盛放药品 Y 的仪器名称。
②若用甲装置制取氧气,则试剂 X 是,反应的化学方程式;用乙装置收集氧气, A 端应与(填“B”或“C”)端相连。
③若 X 是稀盐酸、Y 是石灰石,用甲、乙两套装置可组成发生、净化、检验、收集 CO2 气体的系列装置。若要检验 CO2 , 乙中盛放的试剂及现象
④若 X 是水,Y 是 CaC2 固体,可用于实验室制取乙炔(化学式:C2H2)气体,同时还生成一种碱,试写出反应的化学方程式。乙炔微溶于水,密度与空气接近,若用乙装置收集乙炔,则乙中应该装入。
[提出问题]:敞口放置一段时间的碱石灰样品中的成分是什么?
[问题猜想]:碱石灰样品中可能含有 CaO、NaOH、、CaCO3 和 Na2CO3 五种物质,猜想含有碳酸钠的依据。(用化学方程式表示)
[查阅资料]:BaCl2 溶液呈中性。
[实验探究]:实验小组进行了以下实验探究。
|
实验步骤 |
实验现象 |
实验结论及分析 |
|
①取少量样品与烧杯中,加入少量水。 |
烧杯底部不发热。 |
原样品中一定不含。 |
|
②向上述烧杯中继续加入足量的水,搅拌、过滤。 |
得到白色滤渣和无色滤液。 |
原样品中不一定含 CaCO3 , 用化学方程式表示原因。 |
|
③向滤液中加入过量的 BaCl2 溶液,搅拌。 |
|
原样品中一定含碳酸钠。加过量 BaCl2溶液的作用是。 |
|
④向③所得清液中滴加无色酚酞试液。 |
酚酞变红。 |
原样品中含(选填“一定”、“可能”、“一定不”)[问题猜想]中你填写的物质。 |