| 目的 | 操作 | |
| A | 配制100克36%的浓盐酸 | 将200克18%的稀盐酸加热蒸发100克水 |
| B | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
| C | 称取9.2克氢氧化钠固体 | 托盘天平石盘加9克砝码,游码置于0.2克处,左盘加氢氧化钠固体至天平平衡 |
| D | 检验溶液中是否含有CO32- | 滴入稀硫酸,将产生的气体通入澄清石灰水中 |

|
物质 |
溶解度/(g/100g水) |
||
|
0℃ |
40℃ |
80℃ |
|
|
KCl |
28 |
40.1 |
51.3 |
|
NaCl |
35.7 |
36.4 |
38 |
|
K₂Cr2O7 |
4.7 |
26.3 |
73 |
|
Na₂Cr2O7 |
163 |
215 |
376 |
4FeSO4+O2+2H2SO4 2 Fe2(SO4)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。
②整个过程中,要除去340千克H2S,理论上需消耗O2千克。
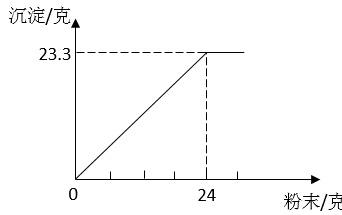
①若该硫酸的质量为1.2a克,加入粉末的质量为30克时,产生沉淀质量为克。
②若粉末的质量为x克,该硫酸的质量为2a克,产生的沉淀的质量为y克。试写出粉末质量x克与产生沉淀质量y克之间的关系。