①C+H2O(g) CO+H2;
②CO+H2O(g) CO2+H2;
H2(g)+1/2 O2(g)=H2O(g);ΔH=-285.8 kJ/mol;写出上述CO与H2O(g)反应的热化学方程式:
A.氢氧化钠溶液
B.氨水
C.石灰水或石灰乳
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图。
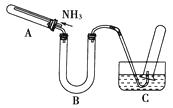
材料一 NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物。如:2NH3+3CuO  3Cu+N2+3H2O;
3Cu+N2+3H2O;
材料二 Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu,Cu2O+2H+=Cu2++Cu+H2O。
请回答下列问题:
可证明还原产物中含有Cu2O的操作及现象是。
实验室模拟合成氨和氨催化氧化的流程如下:
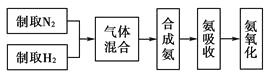
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。

氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有、。

锥形瓶中还可观察到的现象是。