
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1 ②
对于反应: ![]() (g)+ I2(g) =
(g)+ I2(g) = ![]() (g)+2HI(g) ③ ΔH3=kJ·mol −1。
(g)+2HI(g) ③ ΔH3=kJ·mol −1。
A.通入惰性气体 B.提高温度
C.增加环戊烯浓度 D.增加碘浓度

 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。 

该电解池的阳极为,总反应为。电解制备需要在无水条件下进行,原因为。

可知反应平衡常数K(300℃)K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0 , 根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是。
CuCl2(s)=CuCl(s)+ Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+ O2(g)=CuO(s)+
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH= kJ·mol-1。

负极区发生的反应有(写反应方程式)。电路中转移1 mol电子,需消耗氧气L(标准状况)
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是COH2(填“大于”或“小于”)。

可知水煤气变换的ΔH0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=eV,写出该步骤的化学方程式。

计算曲线a的反应在30~90 min内的平均速率 (a)=kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是、。489 ℃时PH2和PCO随时间变化关系的曲线分别是、。
NO+NO2+2OH−=2 +H2O
2NO2+2OH−= +
+H2O
①下列措施能提高尾气中NO和NO2去除率的有(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是(填化学式);吸收后排放的尾气中含量较高的氮氧化物是(填化学式)。
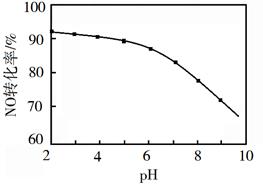
①在酸性NaClO溶液中,HClO氧化NO生成Cl−和 ,其离子方程式为。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是。