 D . H2O的电子式:
D . H2O的电子式: 
在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题:
|
氧化物 |
Li2O |
MgO |
P4O6 |
SO2 |
|
熔点/℃ |
1570 |
2800 |
23.8 |
−75.5 |
解释表中氧化物之间熔点差异的原因。

近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:

图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为( ,
,
),则原子2和3的坐标分别为、。
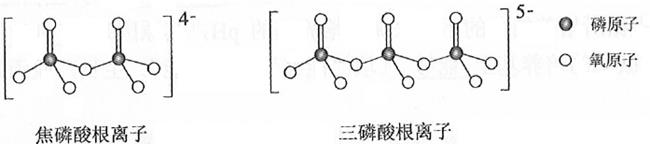
这类磷酸根离子的化学式可用通式表示为(用n代表P原子数)。