| 选项 | 目的 | 实验 |
| A | 制取较高浓度的次氯酸溶液 | 将Cl2通入碳酸钠溶液中 |
| B | 加快氧气的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
| C | 除去乙酸乙酯中的少量乙酸 | 加入饱和碳酸钠溶液洗涤、分液 |
| D | 制备少量二氧化硫气体 | 向饱和亚硫酸钠溶液中滴加浓硫酸 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 | X溶液中一定含有Fe2+ |
| B | 向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成 | Ksp(AgI)> Ksp(AgCl) |
| C | 向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 | Br2的氧化性比I2的强 |
| D | 用pH试纸测得:CH3COONa溶液的pH约为 9,NaNO2溶液的pH约为8 | HNO2电离出H+的能力比CH3COOH的强 |
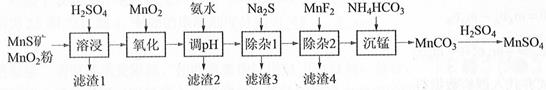
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
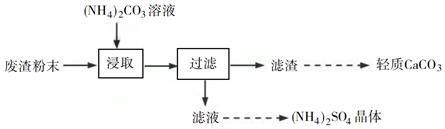

①在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为。
②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差。其原因是“还原料”表面生成了难溶于水的(填化学式)。
③沉淀器中反应的离子方程式为。

回答下列问题:

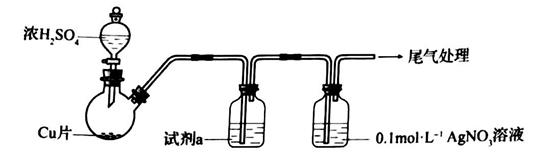
①浓 与Cu反应的化学方程式是
②试剂a是。
(资料: 微溶于水;
难溶于水)
实验二:验证B的成分

①写出 溶于氨水的离子方程式:。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是 ,进而推断B中含有
。向滤液E中加入一种试剂,可进一步证实B中含有
。所用试剂及现象是。
途径1:实验一中, 在
溶液中被氧化生成
,随沉淀B进入D。
途径2:实验二中, 被氧化为
进入D。
实验三:探究 的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有;取上层清液继续滴加 溶液,未出现白色沉淀,可判断B中不含
。做出判断的理由:。
②实验三的结论:。
根据上述实验所得结论:。