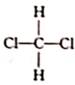
 和
和  是同一物质
C . 甲烷与异丁烷互为同系物
D . 乙烯、乙酸的官能团分别是碳碳双键、羧基
是同一物质
C . 甲烷与异丁烷互为同系物
D . 乙烯、乙酸的官能团分别是碳碳双键、羧基
 B . 除去Cl2中的HCl
B . 除去Cl2中的HCl 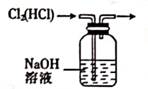 C . 实验室制氨气
C . 实验室制氨气  D . 排水法收集NO
D . 排水法收集NO 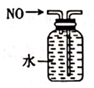
 +HOCH2CH2-O-CH2CH2OH+2H2O
B . CH2=CH2+Cl2+Ca(OH)2→
+HOCH2CH2-O-CH2CH2OH+2H2O
B . CH2=CH2+Cl2+Ca(OH)2→  +CH3COOH
D . 2CH2=CH2+O2
+CH3COOH
D . 2CH2=CH2+O2 
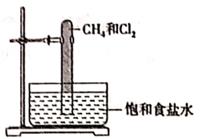
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是(填标号)
A.  B.
B. 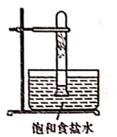 C.
C. 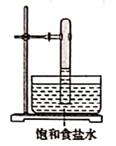 D.
D. 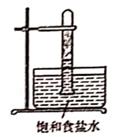

①该物质变化的化学方程式为 。
②2min内Z的平均反应速率为mol·L-1·min-1 .
③该反应进行到2min后, .(填标号)
a.反应已停止
b.X的消耗速率大于Y的生成速率
c.Y的正反应速率等于逆反应速率
d.反应物总物质的量与生成物总物质的量相等

① 电解质溶液为稀H2SO4时,Mg是该电池的 (填“正”或“负”)极。
② 电解质溶液为NaOH溶液时,Al电极上的电极反应式为 。
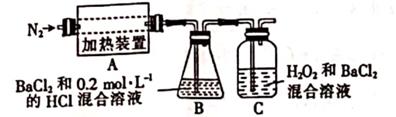
① A中固体充分加热较长时间后,通入氮气,目的是 。
② 为检验A中残留物是否含有FeO,需要选用的试剂有(填标号)
A.KSCN溶液
B.稀硫酸
C.浓盐酸
D.KMnO4溶液
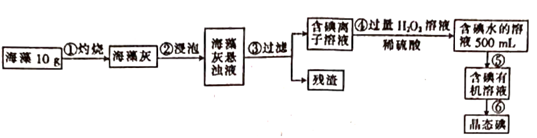
①上述流程中涉及下列操作,其中错误的是(填标号)

②写出步骤④发生反应的离子方程式: 。
③要证明步骤④所得溶液中含有碘单质,可加入(填试剂名称),观察到 (填现象)说明溶液中存在碘。
①Fe粉与稀硝酸反应生成硝酸铁的化学方程式为 。
②反应结束后的溶液中Fe3+、Fe2+的物质的量之比n(Fe3+):n(Fe2+)=。
③标准状况下,生成NO气体的体积为 L(保留两位小数)。