
①Ca(ClO)2可用于杀菌、消毒 ②液氨可用作致冷剂
③Fe2O3常用作红色油漆和涂料 ④SO2可用来漂白馒头、银耳等食品
①分子晶体中都存在共价键; ②在晶体中只要有阳离子就一定有阴离子;
③金刚石、NaF、NaCl、H2O、H2S晶体的熔点依次降低;
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键;
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti3+和12个O2-相邻;
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合;
⑦晶体中分子间作用力越大,分子越稳定;
⑧氯化钠熔化是离子键被破坏

①镁带着火时,不能用液态CO2灭火剂来灭火的原因是。
②工业上用氯气和消石灰(氢氧化钙乳浊液)反应制取漂白粉。
①胃舒平含有氢氧化铝,可用来治疗胃酸(盐酸)过多。
②电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
![]()

①验证A是否已经收集满的方法是(任写一种)。
②若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
③试写出C与水反应的化学方程式,反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)
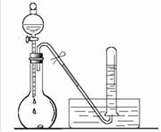

回答下列问题:
