 B . 证明铁生锈是水和氧气共同作用的结果
B . 证明铁生锈是水和氧气共同作用的结果  C . 验证生石灰与水混合后试管中气压变大
C . 验证生石灰与水混合后试管中气压变大  D . 探究二氧化碳不燃烧、也不支持燃烧,密度比空气大
D . 探究二氧化碳不燃烧、也不支持燃烧,密度比空气大 
①Si+O2 SiO2 ②Si+2NaOH+X=Na2SiO3+2H2↑
③SiO2+2C Si+2CO↑④SiO2+Na2CO3
Na2SiO3+CO2↑
下列说法错误的是()

![]()
|
A |
B |
C |
D |
|
|
|
|
|
|
向一定量的稀硫酸中 逐滴滴入氢氧化钾溶 |
等质量的 Zn 块和 Mg 块分别与等体积 |
向硫酸和硫酸铜混 合溶液逐渐加入氢 |
等质量 CaCO3 分别 与等体积等质量分 |
|
液 |
等质量分数的稀硫 |
氧化钠 |
数的稀盐酸(足量) |
|
酸(足量)反应 |
反应 |
| A.归纳物质性质 | B.鉴别常见物质 |
| ①利用互相刻划来比较铜和黄铜的硬度 ②汽油、洗涤剂都能溶解油污 | ①区分聚乙烯和聚氯乙烯:灼烧、闻气味 ②区分双氧水和水:加入MnO2 , 观察现象 |
| C.安全常识 | D.化学与农业 |
| ①煤气泄漏应立即打开排气扇 ②皮肤上沾上浓硫酸立即涂上烧碱溶液 | ①波尔多液可用于农作物杀菌 ② 磷肥可使作物枝叶繁茂、叶色浓绿 |

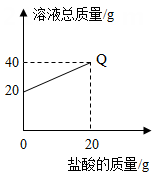 B .
B . 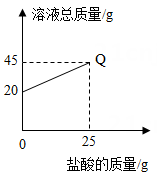 C .
C . 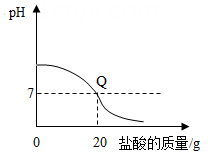 D .
D . 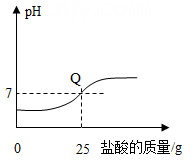

下列说法错误的是( )




①现仅用硝酸钾溶液和磷酸二氢铵配制 100kg 该营养液,则所用的硝酸钾溶液的溶质质量分数为(列出计算式即可)。
②该营养液中的溶质是。

①将固体溶于水得无色透明溶液,加入足量BaCl2 溶液,过滤后得到 5 克白色沉淀。
②在沉淀中加入过量稀硝酸,仍有 3 克白色沉淀。
③在滤液中滴加AgNO3 溶液,产生白色沉淀。
则该固体中一定含有,可能含有。

小柯根据下表进行实验,观察并记录现象。
组别 | 第一组 | 第二组 | ||
A | B | C | D | |
金属 | 锌片 | 绑有铜片的锌片 | 铁片 | 绑有铜片的铁片 |
30%硫酸溶液(mL) | 20 | ? | 20 | 20 |
产生气泡快慢 | 快 | 明显加快 | 慢 | 明显加快 |

【提出猜想】保鲜剂可能的组成:①只有 Fe2O3;②Fe 和 Fe2O3 的混合物。
取保鲜剂样品少量于试管中,加入过量稀盐酸,小组同学根据观察到的现象一致认为猜想②成立,他们观察到的现象是。
称取保鲜剂样品 1.0g 装入硬质玻璃管中,按下图所示的装置进行实验。开始时缓缓通入CO 气体,过一段时间后再加热使其充分反应,待反应完全后,继续通 CO 气体直至玻璃管冷却。
先通入 CO 气体一段时间后再加热的目的是。
|
反应前 |
反应后 |
|
玻璃管和保鲜剂的总质量 128.0g |
玻璃管和固体物质的总质量为127.79g |
①A 装置中发生反应的化学方程式为。
②分析表中的数据后,得出保鲜剂与反应后固体质量差值 0.21g 是(填标号)。
a.保鲜剂中铁的质量
b.保鲜剂中氧化铁的质量
c.保鲜剂中氧化铁与通过反应生成的铁的质量差
实验结束后,是否要先断开A 与 B 的连接以防止B 中的石灰水倒吸?为什么?。

装置B 的作用是和。

步骤 1:利用图甲所示装置,将干燥的O2 从导管 a 通入 U 形管(装置气密性良好,药品如图所示);待 U 形管内充满 O2 后,在导管 b 处连接一活塞推至底部的注射器,收集20mLO2 后在导管 a 处连接乳胶管并用止水夹夹紧,如图乙所示。步骤 2:一段时间后,观察U 形管内的铁丝,其现象如表所示。
| 观察对象 | 现象 |
| ①干燥的普通铁丝 | 没有明显变化 |
| ②潮湿的普通铁丝 | 较多红褐色锈斑 |
| ③潮湿的纯铁丝 | 没有明显变化 |
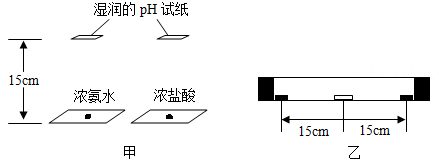
方案I:在两玻璃片上同时分别滴加少量相同体积的浓氨水和浓盐酸,将2张湿润的pH试纸分别置于距玻璃片上方15厘米处(如图甲),比较2张pH试纸变色的时间。
方案II :将一支约35厘米长的玻璃管水平放置,将一湿润的pH试纸置于玻璃管的中间。在玻璃管两端同时分别滴加2滴浓氨水和浓盐酸后,迅速塞上橡皮塞(如图乙),观察pH试纸的颜色变化。
猜想一:生成物中除铜离子外可能还有亚铁离子猜想二:可能与铜离子浓度偏大有关
猜想三:可能是由于温度不同所造成的
|
盐酸溶质质量分数(%) |
0 |
0.18 |
0.36 |
1.8 |
3.6 |
5.5 |
11 |
22 |
|
反应时间(s) |
20 |
18 |
13 |
11 |
21 |
37 |
65 |
114 |
请回答:
|
温度(℃) |
30 |
40 |
50 |
|
NaOH 溶解度(克) |
119 |
129 |
145 |
|
NaCl 溶解度(克) |
36.3 |
36.6 |
37 |

小金设计实验方案可行的是(填字母)。


|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
3.0 |
3.0 |
3.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
192.6 |
193.6 |
192.5 |
|
二氧化碳质量/克 |
请计算药片中碳酸氢钠的质量分数。

①取200g混合溶液加入足量的AgNO3溶液,经过滤洗涤、干燥、称量得到143.5gAgCl固体;
②另取原混合溶液各200与含有杂质的废铁用反应(杂质不溶于水,也不参与反应),共做了五组实验,其实验数据如下表。
|
实验组别 |
一 |
二 |
三 |
四 |
五 |
|
混合溶液质量/g |
200 |
200 |
200 |
200 |
200 |
|
铁屑质量/g |
6 |
9 |
12 |
15 |
18 |
|
析出铜的质量/g |
6.4 |
9.6 |
m |
16 |
16 |
请分析计算: