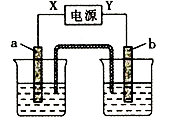
| a电极 | b电极 | X电极 | 电解质溶液 | |
| A | Fe | 石墨 | 正极 | 稀硫酸 |
| B | Zn | Cu | 负极 | CuSO4溶液 |
| C | 石墨 | Pt | 负极 | AgNO3溶液 |
| D | Pt | Cu | 正极 | CuCl2溶液 |
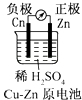 B .
B .  C .
C .  D .
D . 
| | | | |
| 图Ⅰ 碱性锌锰电池 | 图Ⅱ 铅蓄电池 | 图Ⅲ 电解精炼铜 | 图Ⅳ 银锌纽扣电池 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 以酚酞为指示剂,用盐酸标准液滴定氢氧化钠溶液 | 溶液由红色变为浅红色便立刻读数 | 测得氢氧化钠溶液的浓度偏大 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO32-水解引起的 |
| C | 室温下分别测定NaClO溶液、CH3COONa溶液的pH | 前者大 | 酸性:HClO>CH3COOH |
| D | NaHCO3溶液中滴入酚酞 | 溶液变红 | 弱酸的酸式盐溶液均呈碱性 |
|
HCN |
H2CO3 |
CH3COOH |
|
Ka=4.9×10-10 |
Ka1=4×10-7 Ka2=5.6×10-11 |
Ka=1.7×10-5 |

①电解过程中阳极的电极反应式为;
②“镁一次氯酸盐”燃料电池可为图①装置提供电能,该电池电极为镁合金和铂合金,其工作原理如图②所示。b为该燃料电池的(填“正"或“负")极。当有16.6 g Na2FeO4生成时消耗ClO-的物质的量为mol;
|
实验序号 |
消耗NaOH溶液的体积/mL |
待测稀盐酸的体积/mL |
|
1 |
28.84 |
25.00 |
|
2 |
27.83 |
25.00 |
|
3 |
27.85 |
25.00 |
根据表格计算c(HCl)=。在上述滴定过程中,若滴定前碱式滴定管下端尖嘴中无气泡,滴定后有气泡,则测定结果将 (填“偏大”、“偏小”或“不影响”)。
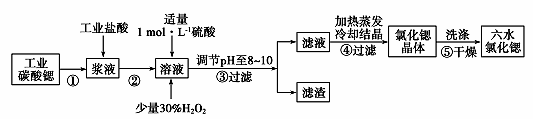
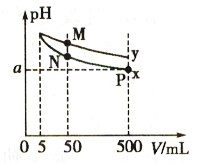
请回答:
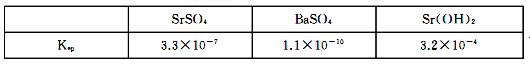
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末